| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《物质的量》试题强化练习(2017年最新版)(二)
参考答案:A 本题解析:溶液中c(Cl-)=溶质的物质的量浓度×化学式中氯离子个数,氯离子的浓度大小与溶液的体积无关,只与溶质的物质的量浓度、化学式中氯离子个数有关,据此进行判断.50mL 0.5mol/L AlCl3溶液 ,Cl—的物质的量浓度为0.5mol/Lx3=1.5mol/L;100mL 0.5mol/L MgCl2溶液氯离子浓度为0.5molx2=1mol/L;100mL1mol/L NaCl溶液氯离子浓度为1mol/L,50mL0.5mol/L HCl溶液氯离子浓度为0.5mol/L,A中离子浓度最大,答案选A. 本题难度:一般 2、选择题 有一定量的14% KOH溶液,加热蒸发掉100g水后,变为80 mL 28%的KOH溶液,此时溶液的物质的量浓度为 参考答案:D 本题解析:根据 本题难度:简单 3、选择题 下列说法正确的是 参考答案:D 本题解析:氯气与NaOH转移电子为;Cl2~e?,7.1g氯气反应转移的电子数为0.1×6.02×1023,A项错;NO与O2反应生成NO2,2 NO2 本题难度:一般 4、选择题 用NA表示阿伏加德罗常数的值。下列叙述中正确的是(?) 参考答案:B 本题解析:A、发生的反应为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O铁过量,故转移0.3电子,错误;B、一个C2H6分子中含有6个C-H极性键,正确;C、二者发生反应为2NO+O2=2NO2,错误。 D、转移2NA,错误。 本题难度:一般 5、实验题 (12分)甲乙两位同学分别用不同的方法配制100mL 3.6mol/L的稀硫酸。 |
参考答案:(12分,每空2分)(1)20mL?
(2)①将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中;
②使溶质完全转移到容量瓶中
③加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切?④ B
(3)不能用量筒配制溶液,不能将水加入到浓硫酸中
本题解析:(1)在稀释过程中,溶质是不变的,所以需要用到浓硫酸的体积为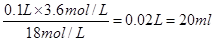 。
。
(2)①转移需要玻璃棒,所以将溶液转移到容量瓶中的正确操作是将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中。
②由于洗涤液中含有溶质,所以洗涤的目的是使溶质完全转移到容量瓶中。
③定容时需要胶头滴管,所以定容的正确操作是加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切。
④根据c=n/V可知。容量瓶中原有少量蒸馏水,不会影响结果;溶液从烧杯转移到容量瓶中后没有洗涤烧杯,则溶质减少,难度偏低;定容时观察液面俯视,则容量瓶中溶液的体积减少,浓度偏高;胶头滴管加水时,有少量水滴到容量瓶外,不影响结果,答案选B。
(3)由于浓硫酸溶于水放出大量的热,且量筒也不能原来稀释溶液,所以错误是不能用量筒配制溶液,不能将水加入到浓硫酸中。
点评:根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。在命题时,有关误差分析的内容既可以以选择题的形式进行考查,也可以以填空题的形式进行考查,既可以考查判断误差导致的结果,也可以考查引起误差的可能原因。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《离子共存》.. | |