微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)根据要求填空:
(1)根据要求写出下列反应的化学方程式:
①有水参加的置换反应,承作氧化剂
②有水参加的氧化还原反应,水既是氧化剂又是还原剂 。
③有水参加的氧化还原反应.但水既不是氧化剂又不是还原剂 。
④有水参加的复分解反应 。
(2)“绿色试剂”双氧水可作为矿业废渣消毒剂,消除采矿业艘液中的氰化物(如KCN)的化学方程式为:KCN+H2O2+H2O=A+NH3↑
①生成物A的化学式为 。
②在标准状况下有0.448L氨气生成.则转移的电子数为 。
③反应中被氧化的元素为 。
(3)同温同压下,同体积的NH3和H2S的质量比是 ;同质量的NH3和H2S的体积比是 ;若两者所吉氢原于个数相等,NH3和H2S的物质的量比是 。
(4)将标准状况下的NH3(g)VL溶于水中,得到密度为b g·cm-3的氨水a g,此时物质的量浓度为c mol·L-1,则溶于水中的NH3(g)的体积V是 L(用a、b、c等表示)。
参考答案:

本题解析:略
本题难度:一般
2、选择题 将铜丝加热后分别放入下列溶液中,取出后经洗涤、干燥,和加热前的铜丝相比质量没有变化的是
A.水
| B.乙醇
| C.醋酸
| D.硫酸
参考答案:B
本题解析:略
本题难度:简单
3、填空题 水(H2O)在很多化学反应中有极其重要的作用。请研究下列水参与的氧化还原反应。
①NaH+H2O=NaOH+H2↑ ?②2Na2O2+2H2O=4NaOH+O2↑
③2Na+2H2O="2NaOH" +H2↑ ?④3NO2+H2O=2HNO3+NO↑
⑤2H2O 2H2↑+O2↑ ?⑥2F2+2H2O=4HF+O2 2H2↑+O2↑ ?⑥2F2+2H2O=4HF+O2
(1)水只作氧化剂的是?;水只作还原剂的是?;水既作氧化剂,又作还原剂的是?;水既不作氧化剂,又不是还原剂的是?。
(2)水作氧化剂时,被还原的元素是?,水作还原剂时,被氧化的元素是?。
参考答案:(1)①③; ⑥; ⑤ ;②④?(2)H? O
本题解析:(1)氧化还原反应中,得到电子化合价降低的反应物是氧化剂,失去电子化合价升高的反应物是还原剂;①该反应中NaH中的H元素的化合价由-1价升高到0价,H2O中的H元素由+1降低到0价,所以氢化钠作还原剂,水作氧化剂;?②该反应中水中的H和O元素的化合价都不变,所以水既不是氧化剂又不是还原剂;③该反应中钠失电子化合价升高,水中氢元素化合价由+1价降低到0价,所以水作氧化剂;④该反应中,水中的H和O元素的化合价都不变,所以水既不是氧化剂又不是还原剂;⑤该反应中,水中氢元素的化合价由+1价降低到0价,水中氧元素的化合价由-2价升高到0价,所以水既是氧化剂又是还原剂;⑥该反应中,水中氧元素的化合价由-2价升高到0价,所以水作还原剂;(2)水作氧化剂时,水中的氢元素化合价降低被还原,氧元素化合价升高被氧化。
本题难度:一般
4、选择题 氧化还原反应实质是( ? )
A.是否有元素的电子转移
B.是否有元素的化合价的变化
C.是否有氧元素的参加
D.是否有原子的重新组合
参考答案:A
本题解析:氧化还原反应实质是电子的转移,而化合价变化是表现,答案选A。
点评:凡是有元素化合价升降的反应都是氧化还原反应,而实质是电子的转移。判断的依据是看化合价是否发生变化。
本题难度:简单
5、填空题 (8分)
(1)写出电子式:
KCl?;CO2?
(2)用电子式表示下列化合物的形成过程:
CaF2:?
NH3:?
参考答案:
(1)写出电子式:
(2)用电子式表示下列化合物的形成过程:
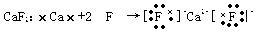 ? ?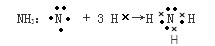
本题解析:(1)钾离子的电子式就是它的离子符号,氯离子最外层得到一个电子就变成八个电子带一个单位负电荷;二氧化碳的碳最外层本来4个电子要想形成8个电子的稳定结构就需要共用4对电子,氧原先最外层6个电子,变成8电子稳定结构需要共用2对电子。
(2)用电子式表示下列化合物的形成过程需要注意离子化合物的电子式和共价化合物的电子式的区别,还有就是标出最外层的8个电子,电荷数与化合价的区别。
本题难度:一般
|