微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
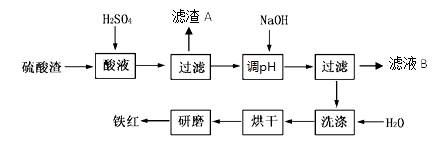
(1)硫酸渣的成分中属于两性氧化物的是?,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式?;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是?(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
|
开始沉淀
| 2.7
| 3.8
| 7.5
| 9.4
|
完全沉淀
| 3.2
| 5.2
| 9.7
| 12.4
|
?
(3)滤渣A的主要成分为?,滤液B可以回收的物质有____________;
(4)简述洗涤过程的实验操作?;
(5)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为?(用最简分数表达式表示)。
参考答案:(1)Al2O3? Fe2O3 + 6H+ ==2Fe3+ + 3H2O
(2)3.2—3.8
(3)SiO2? Na2SO4? Al2(SO4)3? MgSO4
(4)沿玻璃棒向漏斗(过滤器)的沉淀加蒸馏水至淹没沉淀,静置使液体自然流出,重复操作数次(3次)至沉淀洗涤干净。
(5)14m/15w
本题解析:(1)Al2O3为两性氧化物,硫酸渣的成分中属于两性氧化物的是Al2O3;Fe2O3与硫酸反应生成Fe2(SO4)3和H2O,离子方程式是Fe2O3+6H+=2Fe3++3H2O;
(2)由题所给的数据可以看出,要使Fe3+完全沉淀而其它离子不能沉淀,其pH范围是3.2-3.8;
(3)硫酸渣中SiO2不与硫酸反应,所以滤渣A的主要成分是SiO2;加入NaOH调节pH后,Fe3+转化为Fe(OH)3沉淀,其它离子仍为硫酸盐,所以滤液B可以回收的物质有:Na2SO4、Al2(SO4)3、MgSO4。
(4)利用蒸馏水洗涤的方法是,沿玻璃棒向漏斗(过滤器)的沉淀加蒸馏水至淹没沉淀,静置使液体自然流出,重复操作数次(3次)至沉淀洗涤干净。
(5)m kg铁红含铁元素的质量为112m/160,所以硫酸渣中铁元素质量分数为
14m/15w。
本题难度:一般
2、填空题 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.
探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂.
(1)若假设1成立,则实验现象是______.
(2)若滴加?KSCN?试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?______简述你的理由:______.
(3)若固体粉末完全溶解无固体存在,滴加?KSCN?试剂时溶液不变红色,则证明原固体粉末是______,写出发生反应的离子方程式______、______、______.
参考答案:(1)若假设1成立,则溶液中含有Fe3+,遇到KSCN溶液呈红色,故答案为:溶液变为血红色;
(2)如果混合物中含有Cu2O,遇到酸产生Cu,Cu能与Fe3+反应:2Fe3++Cu=2Fe2++Cu2+,则加入KSCN溶液也不变色,故此种说法不正确,
故答案为:不合理;Cu能将Fe3+还原为Fe2+;
(3)固体全部溶解,则一定存在Fe2O3和Cu2O,因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu,反应的有关离子方程式为Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+,
故答案为:Fe2O3和Cu2O的混合物;?Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+.
本题解析:
本题难度:一般
3、选择题 在由Fe、FeO和Fe2O3组成的混合物中加入100 mL 2 mol·L-1的盐酸,恰好使混合物完全溶解,并放出448 mL气体(标准状况),此时溶液中无Fe3+存在。则下列判断正确的是
(?)
A.混合物中三种物质反应所消耗的盐酸的物质的量之比为1∶1∶3
B.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.反应后所得溶液中的Fe2+与Cl-的物质的量之比为1∶3
参考答案:C
本题解析:由题意,由于反应中有气体放出且溶液中不存在Fe3+,则n(Fe)>n(Fe2O3),与FeO的物质的量无关。最终产物为FeCl2,则n(Fe2+)=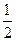 n(Cl-)。
n(Cl-)。
本题难度:简单
4、填空题 (16分)金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:

(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:
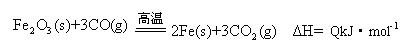
①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为?;
②达平衡后,若温度升高,的值增大,则Q?0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为?(填序号)。?

A.小于l? B.4左右? C.大于6? D.大于9
(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=?:?:?。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是?(填序号)。
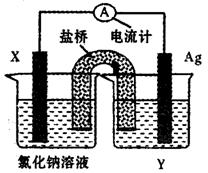
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-
参考答案:(1)-824.4KJ/mol
(2)?①0.03mol·L-1·min-1?②<
(3)①B
(4)6.3:3.4×10-10:6.4×10-35或6.3×1035:3.4×1025:6.4
(5)BD
本题解析:略
本题难度:简单
5、选择题 将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是(? )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中滴入无色KSCN溶液,显黄色
C.Fe2+和Fe3+的物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5
参考答案:C
本题解析:n(Fe)=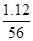 ?mol=0.02 mol,n(Fe3+)=
?mol=0.02 mol,n(Fe3+)=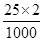 ?mol=0.05 mol,由反应:Fe+2Fe3+=3Fe2+可知Fe3+过量,加入KSCN溶液显红色。反应后溶液中n(Fe2+)=3n(Fe)=0.06 mol,n(Fe3+)=0.01 mol,氧化产物与还原产物的物质的量之比为1:2,D项不正确。
?mol=0.05 mol,由反应:Fe+2Fe3+=3Fe2+可知Fe3+过量,加入KSCN溶液显红色。反应后溶液中n(Fe2+)=3n(Fe)=0.06 mol,n(Fe3+)=0.01 mol,氧化产物与还原产物的物质的量之比为1:2,D项不正确。
本题难度:一般