微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在FeCl3和CuCl2的混合溶液中加入过量的铁粉,若充分反应后溶液的质量没有变化,则原混合溶液中Fe3+和Cu2+的物质的量浓度之比为( )
A.2∶7
B.1∶7
C.7∶1
D.5∶14
2、选择题 工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质。
工业冶炼铜的化学方程式是: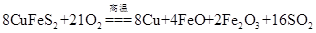
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和____________。
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验。
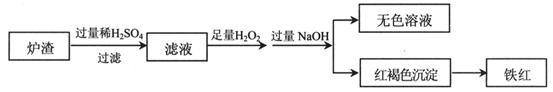
①滤液中的阳离子有Fe3+、Fe2+、H+、_____________。
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是____(填序号)。
?
| 实验方案
| 预期现象
|
a
| 加NaOH溶液
| 产生白色沉淀,变灰绿再变红褐
|
b
| 先加KSCN溶液,再加氯水
| 先无明显现象,后变红
|
C
| 加酸性KMnO4溶液
| 紫色褪去
|
d
| 先加氯水,再加KSCN溶液
| 溶液先变黄,再变红
|
?
③滤液在酸性条件下,与H2O2反应的离子方程式是
______________________________________________________________________。
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收。已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是_____________mol。
3、填空题 [化学——选修化学与生活](15分)
(Ⅰ)合金是生活中常用的材料,请回答下列问题:
(1)生铁和钢是含碳量不同的铁碳合金,含碳量在2%~4.3%的称为?。不锈钢在空气中比较稳定,不易生锈,有强的抗腐蚀能力,其合金元素主要是?;?(2)钢铁的腐蚀给社会造成的损失是巨大的,所以采取各种措施防止钢铁的腐蚀是十分必要的,请列举三种防止钢铁腐蚀的方法?;?
(3)青铜的主要合金元素为?,黄铜的主要合金元素为?:
(4)储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料。如镧镍合金,它吸收氢气可结合成金属氢化物,其化学式可近似地表示为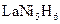 ?(
?(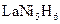 中各元素化合价均可看作是零),它跟
中各元素化合价均可看作是零),它跟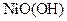 可组成镍氢可充电电池:
可组成镍氢可充电电池:
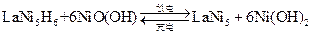
该电池放电时,负极反应是??。市面上出售的标称容量为2000 mA h的1节镍氢电池至少应含有镧镍合金??g(已知1法拉第电量为96500库仑或安培·秒)。
(Ⅱ)有机化合物与生活息息相关。请回答下列有关问题:
(1)棉花、蚕丝、小麦主要成分分别为?、?、?,它们蕃都属于天然有机高分子化合物;
(2)味精是烹饪常用的调味品,其主要成分的化学名称为?;?
(3)解热镇痛药阿司匹林主要成分的结构简式为?。
4、简答题 三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3?6H2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3?6H2O晶体.填写下列空白:
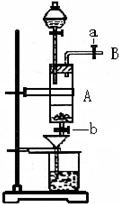
(1)收集导管B处的气体可采用的方法是______.滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是______.
(2)烧杯内放过量稀HNO3的原因是______.发生反应的离子方程式是______.
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是______.
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3?6H2O,而不用直接蒸干的方法来制得晶体的理由是______
(5)你认为该实验存在的缺点可能有:______.
5、选择题 将一定量的铁片和浓硫酸混合加热,充分应后得到溶液X,X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用(?)
A.KSCN溶液和氯水
B.铁粉和KSCN溶液
C.浓氨水
D.酸性KMnO4溶液