微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 元素A~G是元素周期表中的7种短周期元素,请根据表中信息回答下列问题:
| 元素 | A | B | C | D | E | F | G
性
质
结
构
信
息
制成的高压灯,发出的黄光透雾能力强、射程远.
工业上通过分离液态空气获得其单质.原子的最外层未达稳定结构.
常温常压下是气体,元素的常见化合价为-1及多种正价.
+2价阳离子核外电子数与氖原子相同. | E和F是同主族元素,都有同素异形体.E的一种分子与F原子电子数目相同.
常温下,其单质能与烧碱溶液反应放出气体,其氧化物能与强酸或强碱溶液反应.
|
(1)上表中与B元素同周期的元素符号是______.
(2)写出D离子的结构示意图______.
(3)写出C单质与水反应的化学方程式______.
(4)写出G与烧碱溶液反应的离子方程式______.
(5)写出F元素常见的两种同素异形体的名称______.
(6)对元素B的单质或化合物描述正确的是(填序号)______.
①B元素的最高正价为+6?②常温常压下,其单质很难与其他物质反应
③单质分子中含有18个电子?④其氢化物极易溶于水
(7)C、E和F?三种元素的氢化物中,沸点最高的氢化物的化学式是______;C和F?两元素的氢化物中,还原性较强的是(填名称)______.
(8)A和D?两元素金属性较强的是(填元素符号)______.写出能证明该结论的一个实验事实______.
参考答案:元素A~G是元素周期表中的7种短周期元素,A制成的高压灯,发出的黄光透雾能力强、射程远,则A为Na;C单质常温常压下是气体,元素的常见化合价为-1及多种正价,则C为Cl元素;D元素+2价阳离子核外电子数与氖原子相同,则D为Mg元素;E和F是同主族元素,都有同素异形体.E的一种分子与F原子电子数目相同,则E为氧元素、F为硫元素;常温下,G的单质能与烧碱溶液反应放出气体,其氧化物能与强酸或强碱溶液反应,则G为Al元素;工业上通过分离液态空气获得B的单质.原子的最外层未达稳定结构,则B为氮元素,
(1)由上述分析可知,上表中与B元素同周期的元素符号是N,
故答案为:N;
(2)D为镁元素,镁离子的结构示意图为:
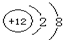
,
故答案为:
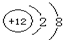
;
(3)C为Cl元素,氯气与水反应的化学方程式为:Cl2+H2O=HClO+HCl,
故答案为:Cl2+H2O=HClO+HCl;
(4)G为Al元素,AlG与烧碱溶液反应的离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,
故答案为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
(5)F为硫元素,常见的两种同素异形体的名称为:斜方硫、单斜硫,
故答案为:斜方硫、单斜硫;
(6)B为氮元素
①N元素的最高正价为+6,故①错误;
②常温常压下,氮气分子含有N≡N三键,化学性质物质,很难与其他物质反应,故②正确;
③氮气分子中含有14个电子,故③错误;
④氨气极易溶于水,故④正确;
故答案为:②④;
(7)C、E和F?三种元素的氢化物分别为HCl、H2O、H2S,常温下H2O为液态,HCl、H2S为气体,H2O的沸点最高;
非金属性Cl>S,故HCl、H2S中,还原性较强的是硫化氢,
故答案为:H2O;硫化氢;
(8)同周期自左而右金属性减弱,故金属性Na>Mg,Na与水反应比Mg与水反应剧烈或氢氧化钠的碱性比氢氧化镁强,可以证明Na的金属性强,
故答案为:Na;Na与水反应比Mg与水反应剧烈或氢氧化钠的碱性比氢氧化镁强.
本题解析:
本题难度:一般
2、选择题 我国将与德国合作,在近期启动钻探“可燃冰”的实物样品的工作,实现“可燃冰”钻探零的突破.“可燃冰”的主要成分是甲烷水合物[CH4?nH2O]晶体.有关甲烷水合物的说法正确的是( )
A.它属于原子晶体
B.它属于混合物
C.可燃冰可以燃烧说明水具有可燃性
D.甲烷水合物中H2O是极性分子,CH4是非极性分子
参考答案:A、可燃冰在减压或升温后可释放出甲烷气体,说明可燃冰沸点较低,稳定性较弱,为分子晶体所具有的性质,故可燃冰晶体是分子晶体,故A错误;
B、可燃冰为甲烷水合物,有固定组成,属于纯净物,故B错误;
C、可燃冰燃烧是因为减压升温后释放出的甲烷而燃烧,不是H2O燃烧,故C错误;
D、水分子为V形,正负电荷中重心不重叠,为极性分子,甲烷为正四面体结构,正负电荷重心重叠,为非极性分析,故D正确.
故选D.
本题解析:
本题难度:一般
3、填空题 [物质结构与性质]碳是形成化合物种类最多的元素。
(1)CH2=CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为________(填最简整数比),写出该分子中所有碳原子的杂化方式:________________。
(2)乙醇(CH3CH2OH)和二甲醚(CH3OCH3)的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是_______________________________。
(3)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为________________。
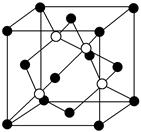
(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。如图所示为碳化硅的晶胞(其中 为碳原子,
为碳原子, 为硅原子)。每个碳原子周围与其距离最近的硅原子有________个。设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为________(用含a、b的式子表示)。
为硅原子)。每个碳原子周围与其距离最近的硅原子有________个。设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为________(用含a、b的式子表示)。
参考答案:(1)2∶1 sp2、sp (2)乙醇分子之间形成氢键
(3)3d84s2 (4)4 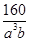
本题解析:(1)凡单键均为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,故CH2=CH—C≡N中含有6个σ键,3个π键,故σ键和π键的个数之比为2∶1。分子中所有碳原子的价电子均参与形成了共价键,第一个和第二个碳原子有3个σ键,采取sp2杂化,而第三个碳原子只有2个σ键,采取sp杂化。
(2)乙醇分子之间可形成氢键,故其沸点较高。
(3)基态碳原子的未成对电子数为2个,故第四周期第Ⅷ族元素的基态原子有2个未成对电子,其基态价层电子排布式为3d84s2。
(4)由题意碳化硅的结构与金刚石类似,则每个碳原子周围与其距离最近的硅原子应为4个。每个晶胞含有碳原子和硅原子各4个,故每个晶胞的质量为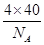 g,每个晶胞的体积为a3 cm3,则
g,每个晶胞的体积为a3 cm3,则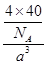 =b g·cm-3,可得NA=
=b g·cm-3,可得NA=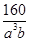
本题难度:一般
4、选择题 下列电子式中,书写正确的是( )
A.氮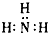
B.氯化氢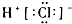
C.氮气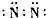
D.氯化镁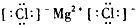
参考答案:A.氮原子为成键的孤对电子未画出,氨气分子中氮原子与氢原子之间形成1对共用电子对,电子式为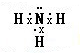 ,故A错误;
,故A错误;
B.HCl属于共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对,HCl电子式为 ,故B错误;
,故B错误;
C.氮气分子中氮原子之间形成3对共用电子对,电子式为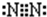 ,故C错误;
,故C错误;
D.氯化镁属于离子化合物,由镁离子与氯离子构成,电子式为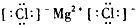 ,故D正确;
,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
[? ]
A.质量数为16的氧原子: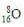 ?
?
B.纯碱的化学式:NaHCO3?
C.Mg2+结构示意图: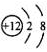
D.铁丝在氯气中燃烧的化学方程式:Fe+Cl2 FeCl2
FeCl2
参考答案:C
本题解析:
本题难度:简单