微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 发现电子的科学家是? (? )
A.汤姆生
B.卢瑟福
C.玻尔
D.道尔顿
参考答案:A
本题解析:A正确,汤姆生发现电子的科学家;B错,卢瑟福发现的原子结构不是一个实心的球体;C错,玻尔在卢瑟福的基础上进一步研究了原子结构;D错,道尔顿提出了原子的学说。
本题难度:简单
2、选择题 按照第一电离能由大到小的顺序排列错误的是?)
A.Be、Mg、Ca?B.Be、B、C、N
C.He、Ne、Ar? D.Li、Na、K
参考答案:B
本题解析:同周期中,从左到右第一电离能由小到大,同主族中从上到下,第一电离能由大到小,故A、C、D正确,B不正确。
本题难度:一般
3、选择题 元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.分子晶体? B.离子晶体? C.原子晶体? D.金属晶体
参考答案:C
本题解析:由题意可知(a+b)=8,而由A元素原子的最外层电子数为a,次外层电子数为b可知A元素,若有个三个电子层数,则b为8不符合。所以A元素只能有两层电子数固b为2、a为6.所以元素A应为氧元素。B元素应为硅元素。所以AB组成的的化合物为氧化硅,为原子晶体。所以答案选C
本题难度:一般
4、选择题 从下列事实所得出的相应结论正确的是( )
?
| 实验事实
| 结 论
|
①
| A元素的原子半径比B元素的原子半径大
| 周期表中A位于B的下一周期
|
②
| 将CO2通入到Na2SiO3溶液中产生白色浑浊(H2SiO3)
| 酸性:
H2CO3>H2SiO3
|
③
| 将燃烧的镁条放入CO2中能继续燃烧
| 还原性:Mg>C
|
④
| 常温下白磷可自燃而氮气须在放电时才与氧气反应
| 非金属性:P>N
|
⑤
| 某无色溶液中加入硝酸酸化的硝酸钡溶液产生白色沉淀
| 原溶液一定有SO42-
|
A.③④⑤
B.①②③⑤
C.②③
D.全部
参考答案:C
本题解析:①如同一周期时左边的原子半径大于右边原子半径;④N2分子之所以稳定其原因是N2分子中含有键能较大的氮氮三键;⑤原溶液中若有SO32-也会产生白色沉淀。
本题难度:一般
5、选择题 月球含有丰富的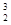 He。下列关于
He。下列关于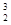 He的说法不正确的是? ( )
He的说法不正确的是? ( )
A.核外电子排布为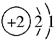
B.原子核内有1个中子
C.与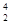 He互为同位素
He互为同位素
D.比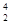 He具有相同的质子数
He具有相同的质子数
参考答案:A
本题解析: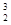 He和
He和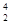 He的核外电子数相等,都为2。
He的核外电子数相等,都为2。
本题难度:一般