微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡“一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
参考答案:从工业生产的实际出发,外界条件只影响化学反应速率的大小,不影响原料的转化率,但根据化学平衡理论,结合影响化学平衡移动的因素,可根据反应方程式的特点,可选择合适的温度、压强,促进平衡向正反应方向移动,从而使原料尽可能多地转化为产品,提高反应物的转化率,很明显C项错误.
故选C.
本题解析:
本题难度:一般
2、选择题 下图表示反应

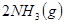 ;
;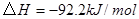 。在某段时间
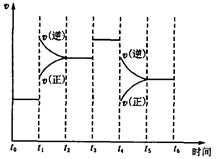
。在某段时间 中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
A.
B.
C.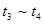
D.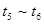
参考答案:A
本题解析: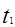 时刻改变条件,逆向速率大于正向,所以平衡逆向移动,氨的百分含量减小。
时刻改变条件,逆向速率大于正向,所以平衡逆向移动,氨的百分含量减小。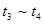 平衡没有发生移动。
平衡没有发生移动。 之后,逆向速率大于正向,平衡继续逆向移动,其含量继续减小。所以最初的平衡状态氨的百分含量最高
之后,逆向速率大于正向,平衡继续逆向移动,其含量继续减小。所以最初的平衡状态氨的百分含量最高
本题难度:一般
3、填空题 (8分)为了研究MnO2与双氧水(H2O2)的反应速率,某学生加少许的MnO2粉末于 50 mL密度为1.1g?cm-3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如下图所示。请依图回答下列问题:
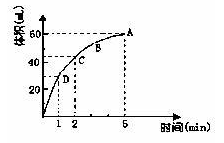
(1)实验时放出气体的总体积为? ___?;
(2)放出一半气体所需要的时间为? ___?;
(3)ABCD四点化学反应速率的由快到慢顺序为 ____? _______ ;
(4)在5min后,收集到的气体体积不再增加,原因是?。
参考答案:(8分) (1)60mL?;?(2)1min?;?(3) D>C>B>A ;(每空2分)?
(4)此时双氧水已经完全分解;(2分)
本题解析:(1)根据图像可知,当气体的体积达到60ml时,就不再发生变化,所以实验时放出气体的总体积是60ml。
(2)当反应中生成3ml气体时,所用的时间是1min。
(3)反应速率越大,反映在曲线上,斜率就越大,所以ABCD四点化学反应速率的由快到慢顺序为D>C>B>A。
(4)5min后,收集到的气体体积不再增加,这说明反应物双氧水已经完全分解,不再产生氧气。
本题难度:一般
4、选择题 下列说法正确的是 ( )
①参加反应的物质的性质是影响化学反应速率的主要因素②光是影响某些化学反应速率的外界条件之一③决定化学反应速率的主要因素是浓度 ④不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率
A.①②
B.②③
C.③④
D.①④