微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
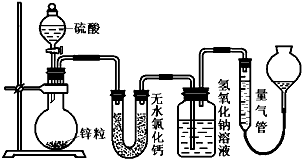
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是
__________(选填:200,400,500)mL。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:
________________________。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,则有:
ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意:___________________、
_________________、__________________。
2、简答题 硼镁泥是一种工业废料,主要成分是MgO(约占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4?7H2O的流程如图:

(1)实验中需要1.00mol/L的硫酸1000mL,若用98%的浓硫酸(p=1.84g/mL)来配制.下列所给的容器中,属于配制该硫酸溶液必须使用的有______(填写选项字母)
A.容量瓶B.分液漏斗C.蒸馏烧瓶D.烧杯E.玻璃棒F.天平
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl+,还有一种离子也会被NaClO氧化,该反应的离子方程式为______
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有______
(4)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是______
(5)已知MgSO4、CaSO4的溶解度如下表
| 温度(°C) | 40 | 50 | 60 | 70
MgSO4?
30.9
33.4
35.6
36.9
CaSO4?
0.210
0.207
0.201
0.197
|
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据简要说明操作步骤______
(6)“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO4?7H2O.
3、实验题 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算。

(1)该小组设计了如上图所示的实验装置,检查该装置气密性的操作是________________。
(2)若在烧瓶中放入1.30 g锌粒,与c mol/L H2SO4反应,为保证实验结论可靠,量气管的适宜规格是(填字母)____。
A.100 mL B.200 mL C.400 mL D.500 mL
(3)若1.30 g锌粒完全溶解,氢氧化钠洗气瓶增重0.64 g(烧瓶中残留气体忽略不计,下同),则圆底烧 瓶中发生反应的化学方程式为______________________。
(4)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg,量气管中收集到V mL气体(标准状况),请用一个代数式表示出a、b、V之间的关系___________。
(5)若撤走盛有无水氯化钙的U形管,则n(H2)/n(SO2)的数值将____(填“偏大”、“偏小”或 “无影响”)。
(6)反应结束后,为了准确地测量气体体积,读数时应注意的事项是:_________、__________
4、选择题 不能鉴别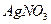 、
、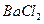 、
、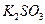 和
和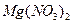 四种溶液(不考虑他们之间的相互反应)的试剂组是?(?)
四种溶液(不考虑他们之间的相互反应)的试剂组是?(?)
A.盐酸、硫酸
B. 盐酸、氢氧化钠溶液
盐酸、氢氧化钠溶液
C.氨水、硫酸
D.氨水、氢氧化钠溶液
5、实验题 测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成I3-,并在溶液中建立如下
平衡:I2 +I-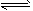 I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用cmol·L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用_________做指示剂,滴定终点的现象是________。
(2)下列对该同学设计方案的分析,正确的是__________(填字母)。
A.方案可行。能准确测定溶液中的c(I2)
B.不可行。因为I-能与Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计)
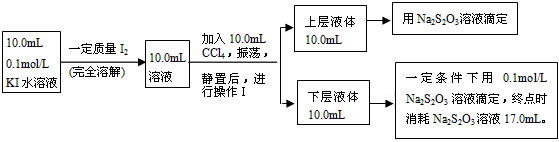
已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值
即 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是_________________(填名称)。试指出该操作中应注意的事项为_______________________。(任写一条)
(4)下层液体中碘单质的物质的量浓度是__________。
(5)实验测得上层溶液中c(I3-)=0.049 mol·L-1,结合上述有关数据,计算室温条件下反应
I2+I- I3-的平衡常数K=__________(用具体数据列出计算式即可)。
I3-的平衡常数K=__________(用具体数据列出计算式即可)。