微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
参考答案:A.液溴易挥发,密度比水大,实验室常用水封的方法保存,故A正确;
B.能使润湿的淀粉KI试纸变成蓝色的物质具有氧化性,可能为NO2、O3、Cl2等物质,但不一定为Cl2,故B错误;
C.CC14层显紫色,证明原溶液中存在I2,I-无色,故C错误;
D.溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,可能为AgCl或BaSO4,不一定含有Ag+,故D错误.
故选A.
本题解析:
本题难度:一般
2、实验题 已知亚甲基蓝( Methylene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White)。亚甲基蓝的结构如图所示。著名的“蓝瓶子实验”操作步骤如下:
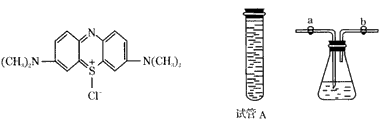
①如图所示,在250mL锥形瓶中,依次加入2g NaOH、100mLH2O、3gC6H12O6(葡萄糖),搅拌溶解后,再加入3~5滴2%的亚甲基蓝溶液,振荡后混合液呈现蓝色;
②关闭活塞a、b,塞紧橡皮塞,将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④关闭活塞a、b,再塞紧橡皮塞,将溶液静置,溶液又变为无色;
以上③、④操作可重复多次。
试回答:
(1)该实验中,影响溶液颜色互变快慢的主要因素有________。
(2)从上述变化的总结果看,葡萄糖的作用是____,亚甲基蓝的作用是____。
(3)上述实验中葡萄糖也可用鲜橙汁代替,因为其中含丰富维生素C,据此可推测维生素C具有____性。
(4)该实验中③、④操作能否无限次重复进行:____(填“能”或“不能”),理由是_____ 。
参考答案:
(1)振荡的剧烈程度(或填溶解氧气的浓度)
(2)还原剂; 催化剂(或催化剂兼作指示剂) |
(3)还原
(4)不能; 一段时间后葡萄糖全部转化为其他物质(注:葡萄糖在 NaOH作用下发生异构化、分解及聚合,当溶液呈黄棕色时反应不能再进行下去)
本题解析:
本题难度:一般
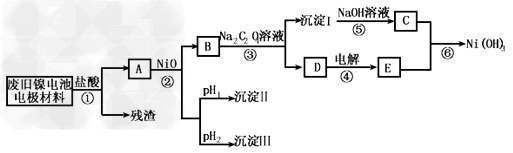
3、实验题 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下
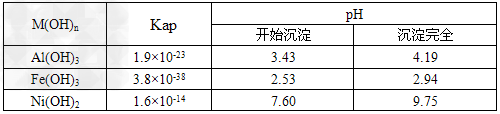
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+ ? ②某温度下一些金属氢氧化物的Kap及沉淀析出的理论pH如下表所示
回答下列问题:
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ________和沉淀Ⅲ_________(填化学式),则pH1________pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用_____。
A.pH试纸 B.石蕊指示剂?C.pH计
(2)已知溶解度:NiC2O4·H2O>NiC2O4·2H2O,则③的化学方程式是______________。第③步反应后,过滤沉淀嘶需的玻璃仪器有_____________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因______________、______________?。
(3)④中阳极反应产生的气体E为____________,验证该气体的试剂为______________。
(4)试写出⑥的离子方程式_____________________。?
参考答案:(1)Fe(OH)3;Al(OH)3;<;C
(2)NiCl2 + Na2C2O4 + 2H2O = NiC2O4·2H2O↓ + 2NaCl;漏斗、玻璃棒、烧杯;玻璃棒划破滤纸;滤液超过滤纸边缘
(3)Cl2;淀粉碘化钾溶液
(4)2Ni(OH)2 + 2OH- + Cl2 = 2Ni(OH)3+ 2Cl-
本题解析:
本题难度:一般
4、实验题 (16分,每空2分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
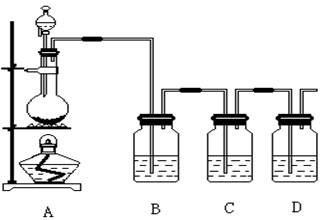
(1)装置A的分液漏斗中盛装的试剂是?,烧瓶中的化学反应方程式 ?。
(2)装置B所加试剂饱和NaCl溶液,其装置的作用是??。
(3)装置C中盛放的试剂是?(选填下列所给试剂的代码),实验现象为?,
该反应的离子方程式是??。
A.Na2S溶液? B.Na2SO3溶液? C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可说明氯比硫非金属性强的是?
A.全部? B.②③④⑥⑦? C.①②④⑤⑥? D.除 ①以外
(5)装置D中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式?。
参考答案:(16分)(1)浓盐酸?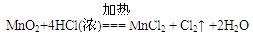
(2)??除去Cl2中的HCl气体
(3)A?; ?有淡黄色沉淀生成或者溶液变浑浊 ?;?S2-+Cl2=2Cl-+S↓ ?(4)B
(5)?Cl2+ 2OH_ ="==" Cl- + ClO- + H2O
本题解析:
(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2.故答案为:浓盐酸;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此B应是除去HCl气体的装置,除去Cl2中的HCl气体;
(3)要在C中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为:Na2S+Cl2=2NaCl+S↓。故答案为:A;有淡黄色沉淀生成;
(4)比较非金属性强弱的九条依据。元素在周期表中的相对位置;非金属单质与氢气化合的越容易,非金属性越强;气态氢化物的越稳定,非金属性越强;最高价氧化物对应的水化物的酸性越强,非金属性越强;非金属性强的元素的单质能置换出非金属性弱的元素的单质;非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱;与变价金属反应时,金属所呈价态越高,非金属性越强;几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱;能量:非金属元素原子得电子放热,放热越多离子越稳定,非金属越强。
我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强。
本题难度:一般
5、选择题 实验室有一瓶购置时间较长绿矾(FeSO4?7H2O),老师将其交给化学研究小组某同学检验药品是否有变质现象,这位同学取绿矾做了简单的检验,得出的结论是:已经开始氧化.该同学所用的试剂和判断依据是( )
| 选项 | A | B | C | D
试剂
氯水
氢氧化钠溶液
铁屑
KSCN溶液
现象
出现黄褐色
最终生成红褐色沉淀
绿色
有较浅的血红色
|
A.A
B.B
C.C
D.D
参考答案:A.加入氯水,可将Fe2+氧化为Fe3+,不能检验是否变质,故A错误;
B.加入氢氧化钠溶液,生成的白色沉淀迅速变为灰绿色,最红变为红褐色,不能检验是否变质,故B错误;
C.加入铁屑,无论是否部分变质,最终都为浅绿色FeSO4溶液,不能检验是否变质,故C错误;
D.如变质,溶液中存在Fe3+,加入KSCN溶液,溶液变红,可检验,故D正确.
故选D.
本题解析:
本题难度:简单