微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.提高尾气净化效率的最佳途径是研制高效催化剂
B.提高尾气净化效率的常用方法是升高温度
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
参考答案:A
本题解析:“该反应速率极慢”,故提高尾气净化效率的最佳途径是研制高效催化剂,A说法正确;升高温度的措施在处理尾气时难以实现,故B错;该反应是可逆反应,故C错;平衡常数只与温度有关,故D错。
本题难度:一般
2、选择题 将BaO2放入密闭的真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小
B.BaO量不变
C.氧气压强不变
D.BaO2量增加
参考答案:CD
本题解析:A.平衡常数只与温度有关,温度不变,平衡常数就不变。错误。B. 该反应的正反应是气体体积增大的反应。保持温度不变,缩小容器容积,也就增大了压强,根据平衡移动原理,化学平衡向气体体积减小的反应,即向逆反应方向移动,所以BaO量减小。错误。C.由于温度不变,化学平衡常数就不变,其数值就等于氧气的浓度,浓度不变,因此压强不变。正确。D. 缩小容器容积,平衡逆向移动,所以体系重新达到平衡BaO2量增加。正确。
本题难度:一般
3、选择题 浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为(? )
Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为(? )
A.绿色变深
B.浅绿色变得更浅
C.变黄
D.无明显变化
参考答案:C
本题解析:浅绿色的Fe(NO3)2溶液中加入稀硫酸发生反应:3Fe2+ + NO3- + 4H+ ="===" 3Fe3+ + NO↑ + 2H2O,Fe2+被氧化为Fe3+,溶液由浅绿色变为黄色,选C。
本题难度:一般
4、选择题 某温度下,浓度都是1.0mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z。10min后测得X2、Z的浓度分别为0.4mol/L、0.6mol/L,则该反应的化学方程式可能为
A.X2+2Y2 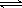 2XY2
2XY2
B.3X2+Y2 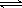 2X3Y
2X3Y
C.2X2+Y2 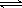 2X2Y
2X2Y
D.X2+3Y3 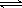 2XY3
2XY3
参考答案:C
本题解析:10min后测得X2、Z的浓度分别为0.4mol/L、0.6mol/L,则X2的浓度变化量是1.0mol/L-0.4mol/L=0.6mol/L。即X2、Z的浓度变化量之比是1︰1,说明二者的化学计量数之比也是1︰1,所以选项C是正确的。答案选C。
本题难度:一般
5、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
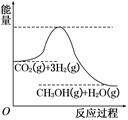
(1)上述反应平衡常数K的表达式为?,温度降低,平衡常数K?(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=?。
t/min
| 0
| 2
| 5
| 10
| 15
|
n(CO2)/mol
| 1
| 0.75
| 0.5
| 0.25
| 0.25
|
?
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是?(填写序号字母)
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol? H2
d.选择高效催化剂
参考答案:(1) 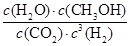 ?增大
?增大
(2)0.15 mol·L-1·min-1
(3)c
本题解析:(1)该反应生成物比反应物能量低,是放热反应;温度降低,平衡正向移动,K值增大。
(2)v(H2)=3v(CO2)=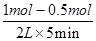 ×3
×3
=0.15 mol·L-1·min-1。
(3)及时分离出甲醇气体会使平衡正向移动,但反应速率减小;升高温度会使反应速率增大,但平衡逆向移动;选择高效的催化剂会加快反应速率,但平衡不移动;保持容器的容积不变,再充入1 mol CO2和3 mol H2,等效于在原平衡的基础上增大压强,化学反应速率增大,平衡正向移动。
本题难度:一般