微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某氯原子的质量为a g , C-12原子的质量为b g,用NA表示阿伏加德罗常数,下列说法中不正确的是
A.则该氯原子构成氯分子的相对分子质量为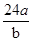
B.1 mol该氯原子的质量为aNA g
C.m g该氯原子的物质的量为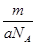 mol
mol
D.n g该氯原子所含的电子数为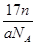
参考答案:D
本题解析:根据原子的相对原子质量等于该原子的质量比的C-12原子的质量的1/12,可以求算出A正确;摩尔质量的定义可知B、C正确;n g该氯原子的原子数为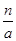 ,电子数为
,电子数为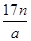 。
。
点评:正确理解物质的量、摩尔质量、相对原子质量是解决本题的关键。
本题难度:一般
2、选择题 镁铝碱式盐对工业污水中的铬有良好吸附性。取该碱式盐0.7525g,滴加1.0mol/L盐酸,当加盐酸21.25mL时开始产生CO2气体,加入盐酸至22.50mL时恰好反应完全,向该溶液中加入过量氢氧化钠溶液,过滤,沉淀物进行干燥后重0.4350g。则该碱式盐的化学式是
A.Al2Mg6(OH)16CO3?4H2O
B.Al4Mg12(OH)34CO3?8H2O
C.Al2Mg4(OH)16CO3?4H2O
D.Al3Mg6(OH)34CO3?8H2O
参考答案:B
本题解析:滴入盐酸后,H+首先与OH-反应,如何再与CO32-反应放出CO2。其中与OH-反应的盐酸是1.0mol/L×0.02125L=0.02125mol,所以OH-的物质的量是0.02125mol。与CO32-反应的盐酸是1.0mol/L×(0.02250-0.02125L)=0.00125mol,所以CO32-的物质的量是0.000625mol。0.4350g沉淀是氢氧化镁,物质的量是0.4350g÷58g/mol=0.0075mol,所以镁离子的物质的量也是0.0075mol,则0.7525g碱式盐中OH-、CO32-和Mg2+的物质的量之比是34:1:12,所以符合条件的应该是选项B,答案选B。
本题难度:一般
3、选择题 下列关于物质的量的叙述中,正确的是(?)。
A.1 mol任何物质都含有6.02×1023个分子
B.0.012 kg12C中含有约6.02×1023个碳分子
C.1 mol水中含有2 mol氢和1 mol氧
D.1 mol Ne中含有6.02×1024个电子
参考答案:D
本题解析:因为有些物质是由分子组成的(例如水、硫酸等),有些物质是由离子组成的[例如NaCl、Ca(OH)2等],还有些物质是由原子直接构成的(例如金刚石等),所以A的叙述是错误的。碳是由原子构成的,所以B错。C中“2 mol氢”和“1 mol氧”没有指明粒子的种类,所以C错。氖原子核外有10个电子,则1 mol Ne含有10×6.02×1023个电子,所以D正确。
本题难度:一般
4、填空题 (5分)含有相同原子个数的SO2和SO3,其质量比为?,摩尔质量比为?,物质的量比为?,其中所含氧原子个数比为?,硫原子个数比为?.
参考答案: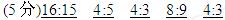
本题解析:略
本题难度:一般
5、计算题 将3.25g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。
求:(1)反应中生成的H2在标准状况下的体积;
(2)所用盐酸中HCl的物质的量浓度。
参考答案:1.12L;0.5mol/L
本题解析:n(Zn)=3.25g÷65g/mol=0.05mol,则根据反应式可知
Zn? +? 2HCl ="=" ZnCl2 ?+? H2↑
1 mol? 2 mol? 1 mol
0.05mol? 0.1mol? 0.05mol
所以V(H2)=0.05mol ×22.4L/mol ="=" 1.12L
c(HCl)= 0.1mol÷0.2L=0.5mol /L
本题难度:一般