微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g) + O2(g) 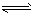 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率。____________________________________
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率。____________________________________
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有__________ (填字母)
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 G.移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为 ____________________________。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是_______________________ 。
2、选择题 在CO(g)+H2O(g)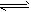 CO2(g)+H2(g)(正反应为放热反应)反应中,改变下列条件,不能使v正增大的是
CO2(g)+H2(g)(正反应为放热反应)反应中,改变下列条件,不能使v正增大的是
[? ]
A.升高温度
B.使用催化剂
C.降低温度
D.增大压强
3、选择题 将装有1mol NH3的密闭容器加热,部分NH3分解后达到平衡,此时混合气中NH3的体积分数为x%;若在同一容器中最初加入的是2mol NH3,密封、加热到相同温度,反应达到平衡时,设此时混合气体中NH3的体积分数为y%。则x和y的正确关系是
[? ]
A.x>y
B.x<y
C.x=y
D.x≥y
4、填空题 光气(COCl2)是一种重要的有机中间体,在农药、医药、工程塑料等方面都有应用。以CO和Cl2为原料合成光气的反应为CO(g)+Cl2(g)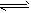 COCl2(g)。某小组同学将不同量的CO和Cl2分别通入体积为2L的恒容密闭容器中进行上述反应,得到如下数据:
COCl2(g)。某小组同学将不同量的CO和Cl2分别通入体积为2L的恒容密闭容器中进行上述反应,得到如下数据:
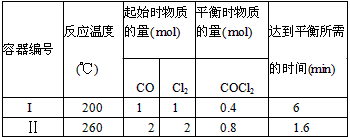
试回答下列问题:
(1)对容器I中的反应,能判断反应达到平衡状态的是_______(填字母)。
A.v正(CO)=v逆(COCl2)
B.三种物质的浓度之比为1:1:1
C.容器内气体密度保持不变
D.容器内压强保持不变
(2)容器Ⅱ中,从开始至达到平衡时,v(Cl2)=________。
(3)该反应的逆反应为____(填“吸热”或 “放热”)反应。
(4)其他条件不变,若在t1时刻,将容器Ⅱ的体积增大一倍,请在下图中画出重新达到平衡过程中c(CO)、c(COCl2)的变化曲线(只需画出浓度的变化趋势,无需标出平衡时的具体数值)。
(5)一定体积下,向某恒容密闭容器中充入3 mol CO和3 mol Cl2,发生上述反应,达到平衡后只改变某一条件,平衡体系发生如下变化,请在表中填写改变的条件。

5、选择题 COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:
COCl2(g) CO(g)+Cl2(g) △H <0。下列有关说法正确的是
CO(g)+Cl2(g) △H <0。下列有关说法正确的是
[? ]
A.在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
B.当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率
C.单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大