微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏加德罗常数,下列结论能够成立的是
A.0.1 mol·L-1的Na2CO3溶液中含有CO32-的个数是小于0.1NA
B.1 molFe与足量稀硝酸完全反应转移的电子数为2NA
C.0.2mol·L-1 CuSO4溶液加水稀释至体积增加1倍,其浓度变为0.1 mol·L-1
D.4g NaOH固体溶解1L水中,所得溶液的物质的量浓度为0.1mol/L
参考答案:C
本题解析:A中没有告诉溶液的体积;B中硝酸是足量的,应生成Fe3+;D中是溶剂的体积,不是溶液的体积。答案选C。
本题难度:一般
2、选择题 设NA为阿伏加德罗常数,下列叙述正确的是
A.标准状况下,VL CHCl3含有的碳原子数为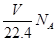
B.常温常压下,1mol乙基所含的电子总数为17NA
C.12g C60中含有60NA个电子
D.1mol HNO3见光分解,转移电子数为4NA
参考答案:B
本题解析:标准状况下,三氯甲烷不是气态,不能适用于气体摩尔体积,A不正确;乙基的化学式是CH3CH2-,含有17个电子,B正确;碳原子的电子数是6个,所以12g C60中含有60×6NA个电子,C不正确;硝酸分解的方程式是4HNO3=2H2O+4NO2↑+O2↑,反应中转移4个电子,所以1mol HNO3见光分解,转移电子数为NA,D不正确,答案选B。
点评:阿伏加德罗常数是历年高考的“热点”问题,为高考必考题目,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
3、选择题 完全中和100mL0.1mol·L-1NaOH溶液,需要(?)
A.100mL0.1mol·L-1H2SO4溶液
B.100mL0.1mol·L-1CH3COOH溶液
C.50mL0.1mol·L-1MgCl2溶液
D.100mLpH=1CH3COOH溶液
参考答案:B
本题解析:100ml0.1mol/L氢氧化钠溶液中氢氧化钠的物质的量是0.1L×0.1mol/L=0.01mol,则需要消耗0.01mol氢离子。选项A中氢离子的物质的量是0.02mol,B中醋酸的物质的量是0.01mol,C中氯化镁的物质的量是0.005mol,醋酸是弱酸,所以选项D中醋酸的物质的量大于0.01mol,因此正确的答案选B。
本题难度:一般
4、填空题 (6分)现有CO2和N2两种气体
(1)当二者的质量相等时,在相同状况下,体积比为 ,密度之比为 , 分子数之比为 。
(2)在相同状况下,当二者的体积相同时,质量比为 ,密度之比为 , 分子数之比为 。
参考答案:(每空1分,共6分)(1)7:11 11:7 7:11 (2)11:7 11:7 1:1
本题解析:(1)根据阿伏加德罗定律可知,在相同条件下,气体的体积之比是需要的物质的量之比。而在质量相等的条件下,气体的物质的量之比是摩尔质量之比的反比,所以CO2和氮气的体积之比是28
本题难度:一般
5、选择题 同温同压下,下列气体所占体积最大的是( )
A.56gN2
B.16gO2
C.32gH2S
D.6gH2
参考答案:同温同压下,气体的Vm相同,由n=mM=VVm可知,气体的物质的量越大,则体积越大,
A.n(N2)=56g28g/mol=2mol;
B.n(O2)=16g32g/mol=0.5mol;
C.n(H2S)=32g34g/mol=0.94mol;
D.n(H2)=6g2g/mol=3mol,
则物质的量最大的是H2,体积应最大.
故选D.
本题解析:
本题难度:简单