|
高考化学知识点整理《原电池原理》高频考点强化练习(2017年最新版)(二)
2017-08-06 11:02:02
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)
Ⅰ、工业上用含有Cr2O72-和CrO42-的废水回收铬。其工艺流程如下:
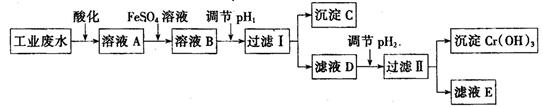
已知:①2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O; Cr2O72-(橙色)+ H2O;
②常温下,Ksp【Fe(OH)3】=1.0×10-38,Ksp【Cr(OH)3】=1.0×10-32;
③当离子浓度小于1.0×10-5mol·L-1时,认为沉淀完全。
(1)下列选项中能说明反应2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。 Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)= v(CrO42-)
C.溶液的颜色不变
D.溶液的PH不变
| (2)为防止FeSO4溶液变质,在保存时需加入的试剂为 (填试剂名称)
(3)过滤操作中需要用到的玻璃仪器有
(4)FeSO4溶液与溶液A发生反应的离子方程式为
(5)沉淀C的化学式为 ,pH2的范围为
Ⅱ、铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
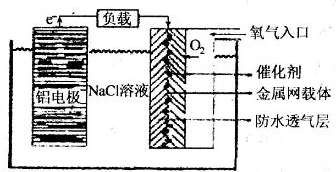
(6)该电池的总反应化学方程式为 ;
(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。
参考答案:(1)cd(各1分,共2分)
(2)铁粉 硫酸 (各1分,共2分)
(3)烧杯 漏斗 玻璃棒 (2分,只要有错不得分)
(4)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O (2分)
(5)Fe(OH)3 (2分) >5 (2分)
(6)4Al+3O2+6H2O=4Al(OH)3 (2分)
(7)2.7g (2分)
本题解析:
(1)2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。 Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。
B. 2v(Cr2O72-)= v(CrO42-),没体现出正反应速率等于逆反应速率,不能判断是否平衡,故B错误。C.溶液的颜色不变,说明物质的浓度不再变化,说明反应达平衡状态。故C正确。D.溶液的pH不变,说明H+浓度不变,化学反应达平衡状态。故D正确。(2)为防止FeSO4溶液变质,在保存时需加入的试剂为铁粉防止氧化,加入硫酸防止亚铁离子水解变浑。(3)过滤操作中需要用到的玻璃仪器有烧杯 漏斗 玻璃棒 。(4)已知工业废水中含有和CrO42-在酸化过程中CrO42-转化为Cr2O72-,所以加入的FeSO4溶液与Cr2O72-溶液发生反应的离子方程式为r2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 。(5)已知常温下,Ksp【Fe(OH)3】=1.0×10-38<Ksp【Cr(OH)3】=1.0×10-32;调节pH1使Fe3+生成Fe(OH)3沉淀而析出,调节pH2目的是使Cr3+转化为Cr(OH)3而析出。由C(Cr3+)c3(OH-)=1×10-32,当Cr3+沉淀完全时
c3(OH-)=1×10-32/C(Cr3+)=1×10-32/1.0×10-5 =1×10-27
c(OH-)=1×10-9,pH=5,pH2的范围为pH2>5.
Ⅱ、(6)铝一空气电池的总反应化学方程式为4Al+3O2+6H2O=4Al(OH)3;(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则生成NaOH的物质的量为0.15 mol。由原电池反应方程式与电解总方程式可得关系式:
Al----3e----3NaOH
27g 3mol
m(Al)×50% 0.15mol
解得: m(Al)=2.7g
考点:了解化学平衡建立的过程。理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 了解难溶电解质的沉淀溶解平衡。了解溶度积的含义及其表达式,能进行相关的计算。解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题考查:化学平衡状态的判断依据:(1)速率判据:v正=v逆。(2)浓度判据:反应体系各物质的浓度(及与浓度相关的量如颜色、气体压强等)不再变化。熟练应用Ksp求算分离或除去某离子时的pH范围。电化学装置中的相关计算常采用电子守恒的方法。
本题难度:困难
2、实验题 (10分)图4-39是用石墨和铁作电极电解饱和食盐水的装置。请填空:
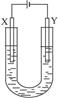
图4-39
(1)X的电极名称是_________极,发生的电极反应式为________,Y极的电极材料是_______。检验X极的产物方法是_____________________。
(2)某同学在实验时误将两种电极材料接反,导致X极上未收到预期产物。一段时间后又将两极的连接方式纠正过来,发现X一端出现了白色沉淀,此沉淀是_______(填化学式)。其形成原因是___________,该沉淀在空气中放置,现象是________________________。
(3)工业上电解饱和食盐水的方法之一,是将两个极室用离子交换膜隔开(如图4-40)其目的是_______,阳极室(A处)加入_______,阴极室(B处)加入_______,离子交换膜只许_________离子通过。
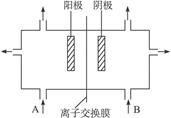
图4-40
参考答案:(1)阳? 2Cl--2e-====Cl2↑? Fe?用湿润的碘化钾淀粉试纸放在管口,若变蓝,说明有Cl2产生
(2)Fe(OH)2铁作阳极时被氧化为Fe2+,纠正错误后,这一端又变为阴极,2H++2e-=====H2↑,生成的OH-与Fe2+结合成Fe(OH)2?先变灰绿色,后变红褐色
(3)防止H2与Cl2混合爆炸,防止Cl2与NaOH生成NaClO使NaOH不纯饱和食盐水纯水(或NaOH稀溶液)? Na+
本题解析:(1)由图可知X与电源正极相连应为阳极,电极反应式:2Cl--2e-====Cl2↑,电极材料为石墨,则Y极电极材料为Fe;用湿润的碘化钾淀粉试纸放在管口,若变蓝,说明有Cl2产生。
(2)若反接则铁会失电子生成Fe2+,与溶液中生成的OH-结合成Fe(OH)2,在空气中先变灰绿色,后变红褐色。
(3)工业上电解饱和食盐水的方法之一是将两个极室用离子交换膜隔开,其目的是防止H2与Cl2混合爆炸,防止Cl2与NaOH生成NaClO使NaOH不纯。
本题难度:简单
3、选择题 下列每组的三种物质中,两边的固体用导线连接后插入中间的液体中,其中能组成原电池装置的是( )
A.Zn|CuCl2溶液|Cu
B.Cu|酒精|Ag
C.石墨|CuSO4溶液|石墨
D.Fe|H2SO4(稀)|Fe
参考答案:A、该装置符合原电池的构成条件,所以能构成原电池,故A正确;
B、酒精是非电解质,酒精和较活泼的金属铜不能自发的发生氧化还原反应,故B错误;
C、两电极材料相同,所以不能构成原电池,故C错误;
D、两电极材料相同,所以不能构成原电池,故D错误;
故选A.
本题解析:
本题难度:简单
4、填空题 如图所示的原电池装置中,锌为?极,电极发生的是?反应(填氧化或还原),电极反应式为?;铜电极反应式为?,铜片上观察到的现象为?。
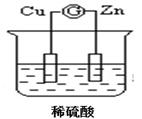
参考答案:(5分) 负?氧化? Zn-2e-=Zn2+? 2H++2e-=H2↑?铜片表面有气泡出现
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据装置图可知,锌的金属性强于铜,所以锌是负极,失去电子,发生氧化反应,电极反应式是Zn-2e-=Zn2+;铜是正极,溶液中的氢离子在正极得到电子,发生还原反应,电极反应式是2H++2e-=H2↑,所以铜片上观察到的现象为铜片表面有气泡出现。
点评:该题是基础性试题的考查,难度不大。明确原电池的工作原理,是答题的关键,有利于调动学生的学习兴趣,激发学生的学习积极性。
本题难度:一般
5、选择题 下图为某兴趣小组制作的番茄电池,下列说法正确的是
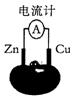
A.电子由锌通过导线流向铜
B.该装置将电能转化为化学能
C.锌电极发生还原反应
D.铜电极上无气泡产生
参考答案:A
本题解析:略
本题难度:简单
| 