微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关化学键与晶体结构说法正确的是
[? ]
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
参考答案:D
本题解析:
本题难度:简单
2、选择题 有A、B和C三种主族元素,若A元素阴离子与B、C元素的阳离子具有相同的电子层结构,且B的阳离子半径大于C,则这三种元素的原子序数大小次序是( )
A.A<B<C
B.B<C<A
C.C<B<A
D.B>C>A
参考答案:A、B和C三种主族元素,若A元素阴离子与B、C元素的阳离子具有相同的电子层结构,原子得到电子生成阴离子,原子失电子生成阳离子,阳离子在阴离子的下一周期,所以原子序数最小的是A;
电子层结构相同的阳离子,阳离子半径随着原子序数的增大而减小,B的阳离子半径大于C,所以B的原子序数小于C,
所以原子序数大小顺序是A<B<C,故选A.
本题解析:
本题难度:一般
3、填空题 (1)微粒2311Na+中的质子数是_______,中子数是_______,核外电子数是_______。
(2)用电子式表示下列化合物的形成过程
H2S____________________;MgF2_______________________。
参考答案:(1)11;12;10
(2)
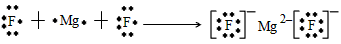
本题解析:
本题难度:一般
4、填空题 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是?。
(2)C、N、O三种元素第一电离能从大到小的顺序是?。
(3)(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是?。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(1)+2N2H4(l)=3N2(g)+4H2O(g)△H=" —103" 8.7kJ.mol—1
若该反应中有4mol N—H键断裂,则形成的 键有?mol。
键有?mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在?(填标号)
a.离子键? b.共价键? c.配位键? d.范德华力
(4)氮化硼(BN)是一种重要的功能陶瓷材料,在与石墨结构相似的六方氮化硼晶钵中,层内B原子与N原子之间的化学键为___?。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为3.615×l0—10m,立方氮化硼晶胞中含有?个氮原子、?个硼原子,立方氮化硼的密度是?g.cm一3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
参考答案:(1)2s22p3(2分)
(2)N>O>C(2分)
(3)①sp3 (2分)?②3(2分) ③d(2分)
(4)共价键(1分)
(5)4(1分)? 4(1分)? ?(2分)
?(2分)
本题解析:(1)根据构造原理可写出基态氮原子的价电子排布式是2s22p3。
(2)非金属性越强,第一电离能越大。但由于N中的2p是半充满,稳定性强,所以第一电离能大于O的,顺序为N>O>C。
(3)①NH3分子中中心原子含有1对孤对电子,所以是三角锥形结构。NH3中氮原子轨道的杂化类型是sp3,而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子轨道的杂化类型是sp3,这个与H2O,H2O2中O的杂化类型都是sp3的道理是一样的。
②根据反应式可知,当反应中有4mol N-H键断裂时,必然会生成1.5mol氮气。由于三键中含有2个π键,所以形成的π键有3mol。
③硫酸铵是离子化合物,含有离子键、极性键、配位键。但没有范德华力。所以答案选d。
(4)B与N为非金属元素,层内B原子与N原子之间的化学键为共价键。
(5)金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,所以金刚石的一个晶胞中含有的碳原子数=8×1/8 + 6×1/2 + 4 = 8,因此立方氮化硼晶胞中应该含有4个N和4个B原子。立方氮化硼的一个晶胞中含有4个N和4个B原子,故“每个BN分子”所占的体积为(361.5×10-10cm)3/4?,每mol的体积为(361.5×10-10cm)3×NA/4,每mol的质量为(361.5×10-10cm)3×NA×ρ/4=25,故立方氮化硼的密度是? 。
。
本题难度:一般
5、选择题 下列物质中含有非极性共价键的离子化合物是?(? )
A.Cl2
B.Na2O2
C.H2O2
D.MgCl2
参考答案:B
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,如果是同一种非金属原子之间形成共价键,则是非极性键,而由不同种非金属元素的原子之间形成的共价键,则是极性键。含有离子键的化合物是离子化合物,据此可知,选项B符合。A是含有非极性键的单质,C是含有极性键和非极性键的共价化合物,D是只有离子键的离子化合物,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题主要是考查学生对化学键概念,以及化学键与化合物关系的熟悉了解程度,有利于培养学生的逻辑推理能力,有助于巩固学生的基础知识,提高学生的应试能力。
本题难度:简单