微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)
Ⅰ.(8分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
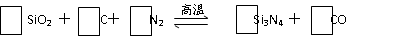
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)若知上述反应每产生2.24LCO气体(折为标准状况)放出Q kJ的热量,则其热化学方程式为? ?
?
(3)用轨道表示式表达Si 核外电子排布情况? ?
?
(4)已知Si的电负性为1.8 ,H的电负性为2.1,N的电负性为3.0 ,则SiH4中硅的化合价为?,Si3N4所属的化合物类型是?(填离子化合物or共价化合物),在前四周期的元素中,未成对电子数最多的元素的电子排布式为?
Ⅱ.(3分)用CH4催化还原NOx可以消除氮氧化物的污染 。例如:
。例如:
CH4(g) +4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
参考答案:

本题解析:略
本题难度:一般
2、选择题 现有如下各说法
①在水中氢.氧原子间均以化学键相结合。
②金属和非金属化合形成离子键。
③离子键是阳离子.阴离子的相互吸引。
④根据电离方程式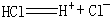 ,判断HCl分子里存在离子键。
,判断HCl分子里存在离子键。
⑤H2分子和Cl2分子的反应过程是H2.Cl2分子里共价键发生断裂生成H.Cl原子,而后H.Cl原子形成离子键的过程。
上述各种说法正确的是
[? ]
A.①②⑤正确
B.都不正确
C.④正确,其他不正确
D.仅①不正确
参考答案:B
本题解析:
本题难度:一般
3、选择题 已知主族元素A和B的原子序数分别为a和b,且原子半径为B>A,则下列说法中正确的是( )
A.a一定大于b
B.若A和B不在同一周期,则a一定大于b
C.a一定小于b
D.若A和B在同一周期,a一定大于b
参考答案:若元素A、B同周期,同一周期,随原子序数递增,原子半径逐渐减小,而原子半径B>A,所以原子序数a>b,故D正确;
若元素A、B同主族,在同一主族,从上到下,原子半径逐渐增大,而原子序数也增大即当原子半径B>A,原子序数b>a.
由于两种情况A、B都有可能,故A、B、C错误.
故选:D.
本题解析:
本题难度:一般
4、选择题
16.下列分子中,键能最小的是?(?)
A.F2
B.Br2
C.Cl2
D.N2
参考答案:
答案:A
本题解析:
N2中含有一个三键,键能较大;F2、Br2、Cl2中只有一个单键,键能小,F2分子中电子“密度”大,F原子间斥力大,键能最小
本题难度:一般
5、选择题 下列说法正确的是(?)
A.用乙醇或CCl4可提取碘水中的碘单质
B.NaCl和SiC晶体溶化时,克服粒子间作用力的类型相同
C.24Mg32S晶体中电子总数与中子总数之比为1︰1
D.H2S和SiF4分子中各原子最外层都满足8电子结构
参考答案:C
本题解析:略
本题难度:简单