微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是( )
A.氢氧化钡溶液中滴加少量稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.NH4HCO3溶液与少量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
D.次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO
参考答案:A.氢氧化钡溶液中滴加少量稀硫酸,生成BaSO4和H2O的物质的量之比为1:2,反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A错误;
B.NH4HCO3溶液与少量NaOH溶液反应,应生成CO32-,反应的离子方程式为HCO3-+OH-=CO32-+H2O,故B错误;
C.向碳酸氢钠溶液中滴入过量澄清石灰水,反应的离子方程式为Ca2++OH-+HCO3-=CaCO3↓+H2O,故C错误;
D.次氯酸钙溶液中通入过量二氧化碳生成HCO3-和HClO,反应的离子方程式为ClO-+H2O+CO2=HCO3-+HClO,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 能用离子方程式“H++OH-═H2O”表示的化学反应是( )
A.4HNO3
2H2O+4H2O↑+O2↑
B.NaOH+HCl=NaCl+H2O
C.Fe2O3+6HCl=2FeCl3+3H2O
D.2H2+O22H2O
参考答案:A.为硝酸的分解反应,不是酸碱中和反应,故A不选;
B.NaOH+HCl=NaCl+H2O的离子反应为H++OH-═H2O,故B选;
C.Fe2O3+6HCl=2FeCl3+3H2O的离子反应为Fe2O3+6H+=2Fe3++3H2O,故C不选;
D.燃烧反应不是离子反应,故D错误;
故选B.
本题解析:
本题难度:简单
3、实验题 (12分)某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、HCO3-、AlO2-、SO42-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是?,肯定不存在的 离子是?,不能确定的离子是?,其检验方法是?
离子是?,不能确定的离子是?,其检验方法是?
?。
(2)按照反应顺序逐步书写出②中发生反应的离子反应方程式①H++OH-=H2O
②?。
③?。
④HCO3-+H+=H2O+CO2↑
⑤?。
参考答案:12分)
(1)OH-、AlO2-、CO32-、K+;(2分)?
NH4+、SO42-、HCO3-、Al3+;(2分)
Cl-;取原溶液加入足量的硝酸酸化,再加入硝酸银溶液,有白色沉淀生成则有Cl -,否则没有。(各1分,共2分)
-,否则没有。(各1分,共2分)
(2) AlO2- + H++H2O = Al(OH) 3 ↓ ?CO32-+H+=HCO3-? Al(OH) 3 +3H+=3H2O+Al3+(各2分,共6分
本题解析:略
本题难度:一般
4、选择题 下列反应的离子方程式,正确的是(?)
A. 溶液与
溶液与 溶液混合:
溶液混合: ↓
↓
B.醋酸除水垢: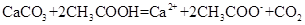 ↑+
↑+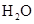
C.漂白粉溶液中通入过量的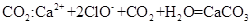 ↓+
↓+
D.少量金属钠放入冷水中: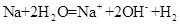 ↑
↑
参考答案:B
本题解析:A、NaHSO4溶液与Ba(OH)2溶液混合,除了生成BaSO4沉淀外,还生成H2O,错误;B、CH3COOH与CaCO3反应生成(CH3COO)2Ca、CO2、H2O,(CH3COO)2Ca为强电解质,拆为离子可得离子方程式,正确;C、过量的CO2反应生成HCO3?,错误;D、没有配平,电荷不守恒,错误。
本题难度:一般
5、选择题 下列反应的离子方程式正确的是
A.Fe(OH)2溶于足量氯水:Fe(OH)2 + 2H+= Fe2++ 2H2 O
O
B.有机物A与足量NaOH溶液共热:
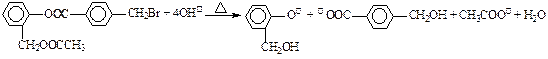
C.碳酸钠固体加入盐酸:Na2CO3 + 2H+= 2Na++ 2H2O + CO2↑
D.NaAlO2溶液与KHCO3溶液混合:AlO2-+ HCO3-+ H2O = Al(OH)3↓+ CO32-
参考答案:D
本题解析:略
本题难度:一般