微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式书写正确的是( )
A.氢氧化钡溶液与硫酸的反应:OH-+H+═H2O
B.铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
C.碳酸钙与盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑
D.铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag
参考答案:A.氢氧化钡溶液与硫酸的反应的离子反应为Ba2++SO42-+2OH-+2H+═2H2O+BaSO4↓,故A错误;
B.铁与稀硫酸反应的离子反应为Fe+2H+═Fe2++H2↑,故B错误;
C.碳酸钙与盐酸反应的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故C正确;
D.铜片插入硝酸银溶液中的离子反应为Cu+2Ag+═Cu2++2Ag,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 把含硫酸铵和硝酸铵的混合液a?L分成两等份.一份加入含b?mol?NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c?mol?BaCl2才能使SO42-完全沉淀,则原溶液中NO3-的物质的量浓度为( )
A.
B.
C.
D.
参考答案:bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,
与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.
令每份中NO3-的物质的量为n,根据溶液不显电性,则:
bmol×1=cmol×2+n×1
解得n=(b-2c)mol
每份溶液的体积为0.5aL,所以每份溶液硝酸根的浓度为c(NO3-)=(b-2c)mol0.5aL=2b-4camol/L.
即原溶液中硝酸根的浓度为2b-4camol/L.
故选B.
本题解析:
本题难度:简单
3、选择题 下列离子方程式书写正确的是
A.NaHS水解反应:HS-+ H2O 
 H3O++ S2-
H3O++ S2-
B.明矾加入在水中起净化作用的原因:Al3++ 3H2O 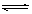 Al(OH)3(胶体) + 3H+
Al(OH)3(胶体) + 3H+
C.氢氧化钡溶液与稀硫酸反应:Ba2++SO 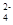 +H++OH-===BaSO4↓+H2O
+H++OH-===BaSO4↓+H2O
D.碳酸氢钠溶液中加入过量Ba(OH)2溶液: