| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《物质的量》答题技巧(2017年最新版)(十)
参考答案:C 本题解析:A:1mol过氧化氢分解转移1mol电子,故0.2 mol过氧化氢完全分解转移的电子数目为0.2NA,错误 本题难度:一般 3、选择题 在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是: 参考答案:B 本题解析:由题知,V甲<V乙,气体的物质的量=气体的体积/气体的摩尔体积,相同条件下,气体的摩尔体积相等。因为V甲<V乙,所以,甲的物质的量比乙的物质的量少, 摩尔质量=物质的质量/物质的量,因为质量相同,甲的物质的量<乙的物质的量少,所以甲的相对分子质量比乙的相对分子质量大。答案选B。 本题难度:一般 4、选择题 设NA表示阿伏加德罗常数,下列叙述中正确的是( ) 参考答案:B 本题解析:A 错误,常温常压下,11.2 L氧气不是0.5mol。 本题难度:一般 5、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是( ) |
参考答案:C
本题解析:
试题解析:溶液体积未知,无法计算Na+离子数,故A错误;浓硫酸随反应进行,浓度减小为稀硫酸不与铜发生反应,生成SO2分子数目小于0.46NA,故B错误;C、标准状况下,22.4 L气体的物质的量为1mol,且氢气和氯气都是双原子分子,故原子总数为2NA,C正确;依据化学方程式定量关系计算,3Fe+4H2O=Fe3O4+4H2,0.10mol Fe粉与足量水蒸气反应生成的H2分子数为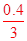 NA,故D错误。
NA,故D错误。
考点:阿伏加德罗常数
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《常见的化学.. | |