微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应式为:4Al + 3O2 +6H2O ===4Al(OH)3下列说法不正确的是( )
A.电池工作时,电流由铝电极沿导线流向铂电极
B.正极反应式为:O2 + 2H2O +4e-=== 4OH-
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
参考答案:A
本题解析:根据化学方程式可知,单质Al失去电子,作还原剂,氧气得到电子,作氧化剂。所以铝是负极,铂电极是正极,氧气在正极得到电子。因此电池工作时,电流由铂电极沿导线流向铝电极,选项A不正确,其余选项都是正确的,答案选A。
点评:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可以进行有关的判断和电极反应式的书写。
本题难度:一般
2、选择题 下列说法正确的是
A.任何化学反应不一定都有反应热
B.使用催化剂可以改变反应的平衡常数
C.升高温度使反应加快,是因为降低了反应的活化能
D.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
参考答案:D
本题解析:A、任何化学反应都伴随着能量的变化,这是化学变化的基本特征之一,A不正确;B、平衡常数只与温度以及化学计量数有关系,与是否使用催化剂无关,B不正确;C、升高温度使反应加快,是因为增大活化分子的百分数,有效碰撞次数增大,而反应的活化能不变,C不正确;D、根据盖斯定律可知,对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同,D正确,答案选D。
本题难度:一般
3、简答题 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu→Cu2++2e-,还原反应式:2Fe3++2e-→2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
(1)将反应Zn+2H+═Zn2++H2↑拆写为两个“半反应式”:其中,氧化反应式为:______.
(2)由题(1)反应,设计成原电池如图所示:若电极a为Zn,电极b可选择材料:______(只填一种);电解质溶液甲是______;电极b处的电极反应式:______.
(3)由反应2H2+O2
2H2O,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极______,正极______.
(4)以惰性材料为电极,电解100mL?pH=6的硫酸铜溶液,当电解池内溶液的pH为1时,电极上析出的铜的质量为______(忽略电解前后溶液体积的变化).
参考答案:(1)根据方程式知,锌失电子发生氧化反应,所以其反应式为:Zn=Zn2++2e-,
故答案为:Zn=Zn2++2e-;
(2)反应Zn+2H+═Zn2++H2↑,若电极a为Zn,电极b为不如锌活泼的金属或导电的非金属,如铜等,电极和相应的电解质溶液含有相同的阳离子,可以是硫酸锌溶液,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:Cu,ZnSO4,2H++2e-=H2↑;
(3)由反应2H2+O2?点燃?.?2H2O,设计出以稀硫酸为电解质溶液的燃料电池,负极上失电子发生氧化反应,电极反应式为:2H2-4e-=4H+,正极上氧气得电子发生还原反应,电极反应式为:O2+4H++4e-=2H2O,
故答案为:负极:2H2-4e-=4H+,正极:O2+4H++4e-=2H2O;
(4)设析出铜的质量是x,
电解硫酸铜溶液的方程式为:2Cu 2++2H2O?电解?.?2Cu↓+O2↑+4H+,
?128g?4mol
?x? 0.1mol/L×0.1L
x=0.1mol/L×0.1L×128g4mol=0.32g,
答:电极上析出的铜的质量为0.32g.
本题解析:
本题难度:一般
4、填空题 (I)将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题:
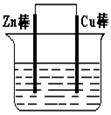
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的?极,可观察到Cu棒上产生现象是?,试用电极反应式表示该现象:?。
(2)若电解质为硫酸铜溶液,则Cu棒上发生?反应(填“氧化”“还原”),Zn棒上发生反应的电极反应式为:?。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为:?。
(II)A、B、C三个烧杯中分别盛有500mL相同物质的量浓度的稀硫酸
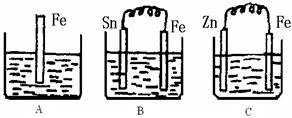
(1)写出A中离子反应方程式:?
(2)一段时间后,B中Sn极附近溶液的pH?(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了5.6L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为?
(4)反应完成后三个烧杯中液体质量大小顺序为:A?B?C (用<、=、>连接)。
参考答案:(I)(1)负极(1分)有无色气泡析出(1分) 2H++2e-=H2↑(2分)
(2)还原(1分) Zn-2e-=Zn2+(2分)
(3)1:32(2分)
(II)(1)Fe+2H+=Fe2++H2↑ (2分)
(2)增大?(1分)
(3)0.5mol·L-1(2分)?
(4)=、<(每空1分)
本题解析:(I)(1)Zn+CuSO4=ZnSO4+Cu↑
负极:Zn-2e-=Zn2+?正极:2H++2e-=H2↑
(2)Zn+H2SO4=ZnSO4+H2↑
负极:Zn-2e-=Zn2+?正极:Cu2++2e-=Cu↑
(3)H2?~? Zn? ~? Cu可知。
(II)B中铁为负极,Sn为正极,2H++2e-=H2↑, pH增大。
C中锌为负极:Zn+H2SO4=ZnSO4+H2↑可求得:
0.25mol? 5.6L
c(H2SO4)=0.5mol·L-1
(4)A、B中均发生反应:Fe+H2SO4=FeSO4+H2↑;C中为::Zn+H2SO4=ZnSO4+H2↑
比较可知:A、B硫酸中增加1molFe,析出1molH2,质量增加54g;而C中硫酸中增加1molZn,析出1molH2,质量增加63g;
本题难度:一般
5、填空题 (14分)⑴甲同学根据漂白液的制备原理和电解原理制作了一种家用环保型消毒液发生器(如图所示),用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源中b为____极,阳极电极反应式为: __________________________;生成漂白液的离子方程式为___________________________________________。
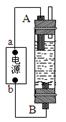
⑵乙同学受此启发,借用此装置制取Fe(OH)2,电解质溶液为硫酸钠溶液,B电极材料为石墨,A电极材料为_________,电极反应式为:A极____________________。通电后,溶液中产生白色沉淀,且较长时间不变色。则看到明显现象后,将电极反接电源,通电后,除了能观察到两极有气泡外还能观察到的明显现象是_____________________________________________________,发生此现象的化学方程式是____________________________________________________。
参考答案:(1)正? 2Cl--2e-=Cl2↑? Cl2+2OH-=Cl-+ClO-+H2O
(2)Fe? Fe-2e-=Fe2+?白色絮状沉淀迅速变成灰绿色,最终变成红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
本题解析:(1)根据装置图可知,A电极生成氢气,被收集,所以A电极是阴极,则a是电源的负极,b是电源的正极,B是电解池的阳极,溶液中的氯离子放电,电极反应式是2Cl--2e-=Cl2↑。由于阴极还产生氢氧化钠,所以生成的漂白液的方程式是Cl2+2OH-=Cl-+ClO-+H2O。
(2)要生成氢氧化亚铁,则A电极材料一定是铁,电极反应式是Fe-2e-=Fe2+。电极反接后,阳极是溶液中的OH-放电,生成氧气。由于氢氧化亚铁极易被氧化,所以现象是白色絮状沉淀迅速变成灰绿色,最终变成红褐色,方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3。
本题难度:一般