微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 反应4NH3(g)+5O2(g)==4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化是①NO:______________,②O2:______________。
2、选择题 在一定温度下,2 L密闭容器内,反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/min
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO))/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
该反应达到平衡状态的时间是
A.3 min? B.1 min? C.2 min? D.0 min
3、填空题 (6分)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应N2O4(g) 2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
| 100
|
n(N2O4)/mol
| 0.40
| a
| 0.20
| c
| d
| e
|
n(NO2)/mol
| 0.00
| 0.24
| b
| 0.52
| 0.60
| 0.60
|
(1)计算a =?,此温度时该反应的平衡常数K=?;
(2)改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号)?。
A.增大N2O4的起始浓度? B.升高温度
C.使用高效催化剂? D.向混合气体中通入稀有气体
4、填空题 (10分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡?移动(填“向左”、“向右”或“不”);使用催化剂反应的△H?(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡?移动(填“向左”、“向右”或“不”);使用催化剂反应的△H?(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-?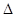 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)?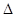 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)?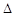 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的?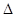 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。
(3)已知:2NO2(g)? ?N2O4(g)?△H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)
?N2O4(g)?△H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g) N2O4(g)达到平衡。写出该反应的平衡常数表达式: ? ,升高温度,该反应的平衡常数K值将 ?(填增大或减小或不变);
N2O4(g)达到平衡。写出该反应的平衡常数表达式: ? ,升高温度,该反应的平衡常数K值将 ?(填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是?(填字母序号)
若其他条件不变时,下列措施能提高NO2转化率的是?(填字母序号)
 ?
?
A.减小NO2的浓度
B.降低温度
C.增加NO2的物质的量
D.升高温度