微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y 2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为? ( )
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为? ( )
A.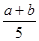 ×100%
×100%
B.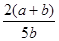 ×100%
×100%
C.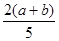 ×100%
×100%
D. ×100%
×100%
参考答案:B
本题解析:方法一:某反应物的转化率(α)= ?×100%,Y的起始物质的量为bmol,所以计算结果的分母中一定含有b,故选B;
?×100%,Y的起始物质的量为bmol,所以计算结果的分母中一定含有b,故选B;
方法二:利用三段式法计算:
X(g)? +? 2Y(g)? ? 2Z(g)
? 2Z(g)
起始:amol?bmol?0
转化:xmol? 2xmol? 2xmol
平衡:(a-x)mol?(b-2x)mol?2xmol
所以(a-x)mol+(b-2x)=2xmol
解得x=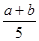 mol
mol
所以Y的转化率为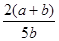 ×100%,故选B。
×100%,故选B。
本题难度:一般
2、选择题 在密闭容器中进行反应:M(g)+N(g) 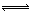 R(g)+2L,此反应符合下图关系,该反应是下列哪种情况
R(g)+2L,此反应符合下图关系,该反应是下列哪种情况
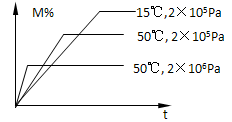
A.正反应吸热,L是固体或液体
B.正反应吸热,L是气体
C.正反应放热,L是固体或液体
D.正反应放热,L是气体
参考答案:A
本题解析:根据图像可知,在温度相同时,压强越大,反应物的含量越低,说明增大压强平衡向正反应方向移动,因此L一定不是气体。同样分析在压强相同时,温度越高,反应物的含量越低,说明升高温度平衡向正反应方向移动,因此正反应是吸热反应。所以答案选A。
本题难度:简单
3、选择题 化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )。
A.K越大,反应物的转化率越小
B.K与反应物的浓度有关
C.K与生成物的浓度有关
D.K与温度有关
参考答案:D
本题解析:K越大,化学反应进行的程度越大,反应物的转化率也越大;一个确定的化学反应,其化学平衡常数只与反应体系的温度有关。
本题难度:一般
4、选择题 在一定温度体积不变的容器中,对可逆反应 的下列叙述中不能说明反应已达到平衡的是(?)
的下列叙述中不能说明反应已达到平衡的是(?)
A C生成的速率与C分解的速率相等?
B单位时间内生成amolA,同时生成3amolC
C容器内各气体的百分含量不再变化?
D混合气体的平均相对分子质量不再变化
参考答案:D
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项ABC都可以说明。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,在反应过程中质量和物质的量都不变的,所以D不能说明,答案选D。
本题难度:简单
5、选择题 一定温度下,一定体积的容器中发生反应:A(s)+3B(g) 2C(g)+2D(g),下列描述中能说明该反应达到平衡的是
2C(g)+2D(g),下列描述中能说明该反应达到平衡的是
①A的质量不发生变化?②单位时间内生成a mol A,同时消耗2a mol C
③容器中的压强不再变化? ④混合气体的密度不再变化
⑤n(A)∶n(B )∶n(C)∶n(D)=1∶3∶2∶2 ?⑥B的浓度不变
A.②③⑤⑥? B.①③④⑥?C.②④⑤?D.②③④
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以①⑥正确;②中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此②中的关系始终是成立,不正确;反应前后气体体积是增大的,所以压强也是增大的,因此容器中的压强不再变化可以说明达到平衡状态,③正确;密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,所以④可以说明;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以⑤不正确,答案选B。
点评:判断化学平衡状态的标志有:(1)任何情况下均可作为标志的:①υ正=υ逆(同一种物质);②各组分含
量(百分含量、物质的量、质量)不随时间变化;③某反应物的消耗(生成)速率、某生成物的消耗(生成)速率
=化学计量数之比;(2)在一定条件下可作为标志的是:①对于有色物质参加或生成的可逆反应体系,颜色
不再变化;②对于有气态物质参加或生成的可逆反应体系,若反应前后气体的系数和相等,则混合气体平
均相对分子质量M和反应总压P不变(恒温恒容);③对于恒温绝热体系,体系的温度不在变化;(3)不能作
为判断标志的是:①各物质的物质的量或浓度变化或反应速率之比=化学计量数之比 (任何情况下均适
用);②有气态物质参加或生成的反应,若反应前后气体的系数和相等,则混合气体平均相对分子质量M
和反应总压P不变(恒温恒容)。
本题难度:一般