微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在通常条件下,下列各组物质的性质排列正确的是(?)
A.熔点:CO2>H2O2>SiO2
B.酸性:HClO>H2SO3>H2CO3
C.沸点:乙烷>戊烷>丁烷
D.热稳定性:HF>H2O>NH3
参考答案:D
本题解析:A、SiO2是原子晶体,熔点最高,CO2和H2O2都是分子晶体,但H2O2是液体,熔点比CO2高,错误;B、H2SO3>H2CO3>HClO,错误;C、结构和性质相似的分子晶体,相对分子质量越大,沸点越高,戊烷>丁烷>乙烷,错误;D、非金属性越强,其对应的非金属氢化物越稳定,同一周期,从左到右,非金属性逐渐增强,HF>H2O>NH3,正确。
本题难度:一般
2、选择题 已知七种短周期元素a~g的有关信息如下表所示:
元素编号
| a
| b
| c
| d
| e
| f
| g
|
原子半径/nm
| 0.037
| 0.074
| 0.082
| 0.102
| 0.143
| 0.152
| 0.186
|
最高化合价或最低化合价
| +1
| -2
| +3
| -2
| +3
| +1
| +1
|
下列推断不正确的是
A.氢化物稳定性的强弱:b>d? B.金属性的强弱:f<g
C.元素e的氧化物只能与酸反应? D.元素a与元素d形成的化合物属于共价化合物
参考答案:C
本题解析:分析表中数据得:a为H元素,f为Na元素,g为K元素,b为O元素,d为S元素,c为Be元素,e为Al元素。
C、元素e为Al元素,既可以与酸反应也可以与碱反应,故错。故选C。
点评:本题考查元素位置结构和性质的关系及应用,题目难度中等,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键。
本题难度:简单
3、填空题 (10分)短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为_______________________。
(2)元素的非金属性为(原子的得电子能力):Q__________R(填“强于”或“弱于”)。(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____________________________________。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________________________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是_______________。
参考答案:(10分)(1) (2)弱于
(2)弱于
(3)S + 2H2SO4(浓)  3SO2↑+ 2H2O
3SO2↑+ 2H2O
(4)2H2O2 2H2O + O2↑?(5)NaNO2?( 每空2分)
2H2O + O2↑?(5)NaNO2?( 每空2分)
本题解析: T所处的周期序数与主族序数相等,则T是铝,所以Q是C,R是N,W是S。
T所处的周期序数与主族序数相等,则T是铝,所以Q是C,R是N,W是S。
(1)铝的原子序数为13,原子结构示意图为?。
(2)同周期自左向右非金属性逐渐增强,所以Q的非金属性弱于R的。
(3)在加热条件下,浓硫酸能氧化单质硫,生成SO2和水,方程式为S + 2H2SO4(浓)  3SO2↑+ 2H2O。
3SO2↑+ 2H2O。
(4)原子序数比R多1的元素的一种氢化物水双氧水,分解生成氧气和水,方程式为2H2O2 2H2O + O2↑ 。
2H2O + O2↑ 。
(5)甲的相对分子质量最小,则甲是NO。NO和氧气的物质的量之比是4︰1,所以根据单质得失守恒可知,NO的氧化产物中氮元素的化合价是+3价,所以是NaNO2。
本题难度:一般
4、填空题 (10分)已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如下转化关系: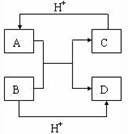
(1)如果A、B、C、D均是10电子的微粒,请写出:
A的结构式?;D的电子式?。
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出:
①A与B在溶液中反应的离子方程式?;
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示):? >?。
(3)已知肼(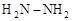 )和甲胺(
)和甲胺(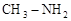 )都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):
)都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):
参考答案:(1)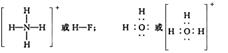
(2)①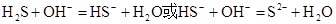 ?②
?②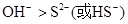
(3)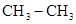 、
、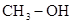 、
、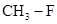
本题解析:(1)如果A、B、C、D均是10电子的微粒,则根据转化图可知,A是NH4+,B是OH-,C是NH3,D是H2O。
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,则A是H2S,C是HS-或S2-,B是OH-,D是H2O。由于酸越弱,相应的酸根越容易结合质子。水是中性的,氢硫酸显酸性,所以结合质子的能力是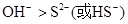 。
。
(3)肼相当于氨气中的氢原子倍氨基所代替,甲胺相当于甲烷分子中的氢原子被氨基代替,所以具有相同电子数的有机化合物的结构简式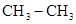 、
、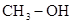 、
、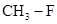 。
。
本题难度:一般
5、选择题 下图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是
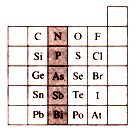
A.N元素为第一周期元素
B.PH3的稳定性比H2S强
C.该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H3AsO4的酸性比H3PO4弱
参考答案:D
本题解析:N元素属于第二周期元素,A不正确;S元素的非金属性强于P元素的,故PH3的稳定性比H2S弱,B不正确;N元素的最高价氧化物对应的水化物化学式为HNO3,C不正确。由于图中阴影部分元素均属于ⅤA元素,根据元素周期律可知选项D正确
本题难度:简单