微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知短周期元素的离子aA2+、bB+、cC3–、dD–都具有相同的电子层结构,则下列叙述正确的是(?)
A.原子半径:r(A)>r(B)>r(D)>r(C)? B.原子序数:b>a>c>d
C.离子半径:r(C3–)>r(D–)>r(B+)>r(A2+)?D.元素的金属性:A>B>D>C
参考答案:C
本题解析:短周期元素的离子aA2+、bB+、cC3–、dD–都具有相同的电子层结构,所以根据电子层结构相同,半径为原子序数小的大,推得离子半径:r(C3–)>r(D–)>r(B+)>r(A2+),故C正确;而原子半径则是r(A)>r(B)>r(C)>r(D),故A错误;原子序数:a>b>d>c,故B错误,元素的金属性:为B>A,对于CD来说应该是是说非金属性。
点评:本题考查了原子离子半径的比较,属于高考考查的重点,该题要明白电子层结构相同,半径为原子序数小的大的原则和电子层数越多,半径越大的原则。
本题难度:一般
2、选择题 下列各组物质互为同位素的是?(?)
A.O2和O3
B.12H2和13H2
C.612C和613C
D.C2H5COOH与CH3COOCH3
参考答案:C
本题解析:质子数相同,中子数不同的同一种元素的不同核素互称为同位素,所以选项C正确。A中互为同素异形体,B中都是水分子,D中互为同分异构体,答案选C。
本题难度:一般
3、选择题 下列有关化学用语正确的是
A.碳原子的轨道表示式:
B.次氯酸分子的电子式: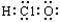
C.CH4Si的结构式:
D.质量数为137的钡原子:
参考答案:A
本题解析:略
本题难度:一般
4、选择题 下列性质的递变规律不正确的是
A.NaOH、KOH、CsOH碱性依次增强
B.Li、Na、K、Rb、Cs单质的失电子能力逐渐增强
C.Al、Mg、Na的原子半径依次减小
D.HCl、H2S、PH3稳定性依次减弱
参考答案:C
本题解析:考查元素周期律知识
A.同主族元素自上而下金属性增强,则最高价氧化物的水化物的碱性增强,正确;
B.同主族元素自上而下金属性增强,单质的失电子能力逐渐增强,正确
C.同周期元素自左向右原子半径逐渐减小,错误
D.同周期自左向右非金属性增强,氢化物稳定性增强,正确
故选项C符合题意
本题难度:一般
5、选择题 下列有关说法错误的是?
A.P、S、Cl元素的最高化合价依次升高
B.H2O、NH3、CH4分子的中心原子均为SP3杂化轨道类型
C.Na、K、Rb第一电离能逐渐增大
D.N、O、F电负性依次增大
参考答案:C
本题解析:C.Na、K、Rb第一电离能逐渐减小,同主族从上往下,第一电离能逐渐减小;?
点评:考查元素的第一电离能和电负性;杂化轨道理论;
本题难度:简单