微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 高锰酸钾是锸的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.
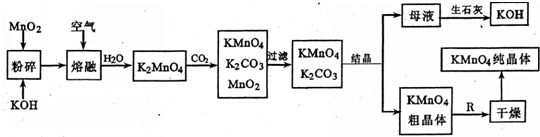
(1)KMn04是______(填颜色)的晶体,其稀溶液是一种常用的消毒剂.其消毒机理与下列______(填序号)物质相似.A.75%酒精?B.双氧水?C.苯酚?D.84消毒液(NaClO溶液)
(2)写出K2Mn04溶液中通入CO2时发生的主要反应的离子方程式______
(3)上述流程图中:①可以循环使用的物质有生石灰、二氧化碳.Mn02和______(写化学式);②KMn04粗晶体变为KMnO4纯晶伴,需经过步骤R,R为______(填实验操作名称).
(4)实际生产中,常用硫酸工业的废气(含S02)与该厂的废水(含KMnO4)按一定比例混合,以减少工业“三废”对环境的污染.写出KMnO4与SO2反应的离子方程式为______
(5)若不考虑物质循环与制备过程中的损失,则1mol?MnO2可制得______mol?KMn04.
参考答案:(1)高锰酸钾晶体是深紫色,KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选:深紫色,BD;
(2)反应中K2MnO4→KMnO4,Mn元素化合价由+6价升高为+7价,共升高变化1价,K2MnO4→MnO2,Mn元素化合价由+6价降低为+4价,共降低2价,化合价升降最小公倍数为2,故KMnO4系数为2,MnO2系数为1.根据Mn元素守恒可知KMnO4系数为3,
根据K元素守恒可知K2C03系数为2,由碳元素守恒可知系数C02为2,方程式为3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2.
故答案为:3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2.
(3)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用,故答案为:KOH;
(4)二氧化硫具有还原性和KMnO4在水溶液中发生氧化还原反应,生成硫酸和硫酸锰,依据氧化还原反应电子守恒和原子守恒配平得到,5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(5)最初的原料中1mol MnO2恰好得到1mol KMnO4.由3K2MnO4+CO2=2KMnO4+K2CO3+MnO2知,1mol K2MnO4在反应中能得到23molKMnO4,即0.67mol;
故答案为:23,或0.67mol;
本题解析:
本题难度:一般
2、选择题 下列关于氧化还原反应的原理分析,正确的是( )
A.失电子越多,该物质的还原性就越强
B.含有最高价元素的化合物一定具有强氧化性
C.氧化剂氧化其他物质时,本身被还原
D.某元素由化合态变成游离态一定被还原
参考答案:A.失去电子能力强,还原性强,失去电子的多少与还原性无关,故A错误;
B.元素处于最高价,能得到电子,在化合物中不一定强具有氧化性,如KCl中K为最高价,不具有强氧化性,故B错误;
C.氧化剂在反应中得到电子,发生还原反应,被还原,故C正确;
D.某元素由化合态变成游离态,可能失去电子也可能得到电子,如2H2S+SO2=3S↓+2H2O,故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 实验室用MnO2与浓HCl制取Cl2:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,下列说法正确的是( )
A.MnO2作氧化剂,发生氧化反应,MnCl2是氧化产物
B.在反应中,表现还原性与表现酸性的浓HCl物质的量之比为2:1
C.每生成1mol?Cl2时,有4mol电子发生转移
D.氧化性:MnO2>Cl2
参考答案:A.MnO2作氧化剂,发生还原反应,MnCl2是还原产物,故A错误;
B.4molHCl参加反应,有2mol被氧化,2mol表现出酸性,则表现还原性与表现酸性的浓HCl物质的量之比为1:1,故B错误;
C.反应中Cl元素化合价变化由-1价到0价,每生成1mol Cl2时,有2mol电子发生转移,故C错误;
D.氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则有氧化性:MnO2>Cl2,故D正确.
故选D.
本题解析:
本题难度:一般
4、简答题 现有下列10种物质:①铁片;②饱和食盐水;③液态硫酸;④乙醇;⑤干冰;⑥熔融硝酸钾;⑦碳酸钙固体;⑧铝条;⑨苛性钠;⑩石墨.
(1)用序号回答:能导电的是______,属于电解质的是______,属于非电解质的是______.
(2)写出①与水反应的化学方程式,并用双线桥表示电子转移的方向和数目.______
(3)写出⑧与⑨的水溶液反应的离子方程式______,该反应的氧化剂为______,还原产物为______.
(4)储氢纳米碳管的研制成功体现了科技的进步.用电弧法合成的碳纳米管常伴有大量的杂质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.?C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种.
请用上述物质填空,并配平化学方程式:
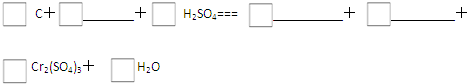
若该反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为______.
参考答案:(1)①铁能导电,是单质,它既不是电解质,也不是非电解质;
②饱和食盐水,能电离出自由移动的钠离子和氯离子,能导电,但它是混合物,它既不是电解质,也不是非电解质;
③液态硫酸是化合物,溶于水能电离出自由移动的氢离子和硫酸根离子,所以能导电,但液态硫酸不导电,它是电解质;④乙醇在水溶液中是以乙醇分子的形式存在,所以不导电,故它为非电解质;
⑤干冰是二氧化碳气体的固态形式,只有二氧化碳分子,不导电,是非电解质;
⑥熔融硝酸钾,是化合物,有自由移动的钾离子和硝酸根离子,所以能导电,故它是电解质;
⑦碳酸钙固体是化合物,溶于水或熔融能电离出自由移动的钙离子和碳酸根离子,所以能导电,是电解质,但碳酸钙固体,无自由移动的离子,不导电;
⑧铝条能导电,是单质,它既不是电解质,也不是非电解质;
⑨苛性钠是化合物,无自由移动的离子,不导电,溶于水或熔融能电离出自由移动的钠离子和氢氧根离子,所以能导电;⑩石墨能导电,是单质,它既不是电解质,也不是非电解质;
故答案为:①、②、⑥、⑧、⑩;③、⑥、⑦、⑨;④、⑤;
(2)铁和水蒸气反应,Fe元素0→+2、+3价,H元素+1→0价,铁元素被氧化,水中的氢元素被还原,可表示为

,
故答案为:

(3)由题意,知反应物铝条和苛性钠,故化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据单质写化学式,氧化物写化学式氢氧化钠、偏铝酸钠拆写成离子;该反应中的氢元素从+1变为氢气中的零价,为氧化剂,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;H2O;H2;
(4)因几种物质中K2Cr2O7具有氧化性,K2Cr2O7在反应中得到电子,而C具有还原性,
氧化反应为C→CO2,还原反应为K2Cr2O7→Cr2(SO4)3,
则反应物为C、H2SO4、K2Cr2O7,生成物为CO2、K2SO4、Cr2(SO4)3和H2O,
配平后的该氧化还原反应的方程式为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O,
由方程式3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O可知,每生成3molCO2时转移的电子为12mol,
则电子转移了0.8mol时,生成的CO2的物质的量为0.2mol,其体积为0.2mol×22.4L/mol=4.48L,
故答案为:3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O;4.48L;
本题解析:
本题难度:一般
5、选择题 HNCO可用于消除汽车尾气中的NO和NO2,其反应原理为:HNCO+NOx→N2+CO2+H2O,下列说法正确的是( )
A.HNCO分子中存在非极性键
B.4.3g?HNCO中含有0.1NA个原子
C.反应中NOx是还原剂
D.1mol?NO2在反应中转移4NA个电子
参考答案:A.HNCO分子结构不对称,正负电荷重心不重叠,为极性分子,故A错误;
B.n(HNCO)=4.3g43g/mol=0.1mol,含有原子个数为0.4NA个,故B错误;
C.反应中NOx为氧化剂,N元素的化合价降低,故C错误;
D.1molNO2在反应中N元素化合价有+4价降低为0价,则转移4NA个电子,故D正确.
故选D.
本题解析:
本题难度:简单