微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在80 ℃时,水的离子积KW=3.8×10-13,该温度时纯水的pH(?)
A.等于7
B.小于7
C.大于7
D.无法确定
参考答案:B
本题解析:纯水呈中性,c(H+)=c(OH-),即使升温至80 ℃时,仍为c(H+)=c(OH-),所以有KW=c(H+)·c(OH-)=[c(H+)]2=3.8×10-13,c(H+)=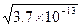 ?mol·L-1=6.16×10 -6 mol·L-1,所以选B。
?mol·L-1=6.16×10 -6 mol·L-1,所以选B。
本题难度:简单
2、计算题 有一pH为12的NaOH溶液100mL,如果将其pH降为11,那么,
(1)若用蒸馏水应加入______mL;
(2)若用pH=10的NaOH溶液应加入______mL;
(3)若用pH=2的盐酸应加入________mL;
(4)若用0.01mol/LH2SO4应加入_____mL。
参考答案:(1)900? (2)1000? (3)81.8? (4)42.85
本题解析:本题考查[H+],pH值的计算。因溶液均很稀,所以混合溶液的体积可用两体积之和来表示。设所加液体的体积为V1mL,V2mL,V3mL,V4mL。
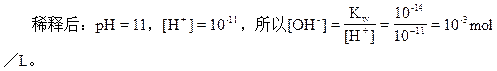
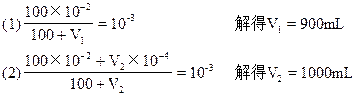
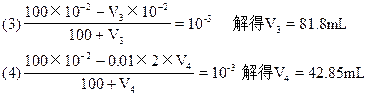
本题难度:一般
3、实验题 (16分)50mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液在右图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热。
(1)烧杯间填满泡沫塑料的作用是?;
(2)大烧杯上若不盖硬纸板,求得的中和热数值?(填“偏大”、 “偏小”、“无影响”)
(3)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H?-57.3KJ/mol(填“>”、“<”或“=”);
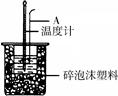
(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量?(填“相等、“不相等”),
所求中和热?(填“相等、“不相等”) 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会?;(均填“偏大”、“偏小”、“无影响”)
(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式?;
参考答案:(1)保温防止热量损失。?(2)偏小?(3)环形玻璃棒;△H>-57.3KJ/mol
(4)不相等、相等?(5)偏小?
(6)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-57.3KJ/mol
本题解析:(1)在实验中应该尽可能的减少热量的损失,所以烧杯间填满泡沫塑料的作用是保温防止热量损失。
(2)大烧杯上若不盖硬纸板,则会造成热量的损失,测定结果偏低。
(3)根据仪器的结构可知,应该是是环形玻璃棒。由于酸能和氢氧化钠反应放出热量,所以造成氢氧化钠溶液的起始温度高,因此导致最终放出的热量偏少,则△H>-57.3KJ/mol。
(4)改变酸和碱的用量,反应中放出的热量会变化,但反应热是不变的,因为中和热是指酸跟碱发生中和反应生成1摩尔H2O时所放出的热量,与酸碱的用量无关。
(5)氨水是弱电解质,存在电离平衡,电离吸热,所以测得的中和热的数值偏小。
(6)根据中和热的概念可知,热化学方程式为1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-57.3KJ/mol。
本题难度:一般
4、填空题 (4分)现有电解质溶液:①Na2CO3?②NaHCO3?③CH3COONa?④ NaOH
(1)当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是?(填编号,以下相同)
(2)在上述四种电解质溶液中,分别加入AlCl3溶液,无气体产生的是?
参考答案:4分(每空2分共4分)
(1)?③②①④?(2)③④
本题解析:略
本题难度:一般
5、计算题 6分)将0.3mol NaCl固体与0.1mol CuSO4?5H2O固体混合溶于水,配成1升混合液。然后取出200ml溶液,用石墨电极,通电一段时间(不考虑水解)。求Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是多少?所得溶液的PH为多少(假设溶液体积不变)?
参考答案:0.224L;? PH=13
本题解析:考查电解以及pH的有关计算。
氯离子在阳极失去电子,方程式为2Cl――2e-=Cl2↑
共计转移电子是0.3mol÷5=0.06mol
阴极是铜离子放电,方程式为Cu2++2e-=Cu
转移电子是0.1mol÷5×2=0.04mol
所以根据电子得失守恒可知,阴极氢离子得到0.06mol-0.04mol=0.02mol
生成氢气的电极反应式为2H++2e-=H2↑
所以氢气是0.01mol,其标准状况下的体积是0.224L。
同时溶液中生成氢氧化钠是0.01mol×2=0.02mol
浓度是0.02mol÷0.2L=0.1mol/L
PH=13
本题难度:一般