微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.常温下某溶液中由水电离出的c(H+)=1×10-amol/L,若a<7时,则该溶液可能为NaHSO4溶液
B.中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸)
C.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:②<③<①
D.已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol·L-1的AgNO3溶液和1×10-4 mol·L-1 K2Cr04溶液混合,会有Ag2CrO4沉淀产生
参考答案:C
本题解析:A、常温下某溶液中由水电离出的c(H+)=1×10-amol/L,若a<7时,说明水的电离是被促进的,应该是能水解的盐溶液。NaHSO4溶液中水的电离被抑制,A不正确;B、盐酸与硫酸是强酸,醋酸是弱酸,因此中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)=V(盐酸) <V(醋酸),B不正确;C、酸性强弱顺序是CH3COOH>H2CO3>C6H5OH,酸越弱水解程度越大,因此pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:②<③<①,C正确;D、等体积的1×10-4 mol·L-1的AgNO3溶液和1×10-4 mol·L-1 K2Cr04溶液混合,溶液中c2(Ag+)·c(CrO42-)=(5×10-5)2×5×10-5=1.25×10-13<1.12×10-12,因此得不到铬酸银沉淀,D不正确,答案选C。
本题难度:一般
2、选择题 下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol?L-1的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
参考答案:C
本题解析:95℃纯水的pH<7是因为水的电离过程吸热,升高温度,促进电离,c(H+)>10-7mol/L,但c(H+)≡c(OH-),仍呈中性,A错误;醋酸是弱酸,稀释过程中醋酸电离补充氢离子,所以稀释10倍后pH<4,B错误;0.2mol/L盐酸中氢离子浓度为0.2mol/L,与等体积水混合后氢离子浓度为0.1mol/L,pH=1,C正确;pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合后醋酸过量,溶液呈酸性,pH<7,D错误。
点评:弱酸稀释过程中电离补充氢离子。
本题难度:一般
3、选择题 一定温度下,水存在H2O H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变
参考答案:B
本题解析:A项,Kw只与温度有关;B项正确;C项,加入CH3COONa,促进水的电离,溶液呈碱性;D项,该题没有指明是常温下,所以c(H+)不一定等于10-7 mol·L-1。
本题难度:简单
4、选择题 已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
③H2(g)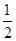 O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
④H2O(g)=H2O(l)ΔH=-44.0 kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
C.氢气的燃烧热为241.8 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=+571.6 kJ·mol-1
参考答案:A
本题解析:燃烧热是指1 mol物质燃烧生成稳定氧化物所放出的热量,C完全燃烧的产物是CO2,CO继续燃烧生成CO2放出热量,那么C的燃烧热大于110.5 kJ·mol-1;浓硫酸中的H+与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量,但是浓硫酸的稀释又有热量释放,所以该反应过程放出的热量大于57.3 kJ;根据盖斯定律,③④相加得到热化学方程式H2(g)+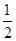 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1,该反应为放热反应,故ΔH的符号为“-”。
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1,该反应为放热反应,故ΔH的符号为“-”。
本题难度:一般
5、填空题 (12分)化学链燃烧是将燃料与载氧体再被空气氧化再生,以实现较低温度下燃烧的过程。该过程具有无火焰、低污染、高效率的特点。
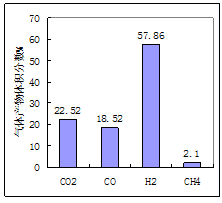
(1)用煤作燃料时,需要先用H2O或CO2将煤转化为燃料气。950℃时,焦炭被H2O氧化后产物的体积分数如图所示、其中H2含量较多的原因是 、(用化学方程式表示)
(2)燃料反应的气体产物主要是H2O和CO2通过 (填操作名称)分离出水,并回收CO2。
(3)CaSO4是一种载体,请写出CaSO4与H2反应的化学方程式 ;CO还原载体CaSO4的主要反应是①,副反应是②
①CaSO4( s)+4CO(g)=CaS(s)+4CO2(g) △H=-175.6 kJ.mol-1
②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) △H=+218.4 kJ.mol-
右图是CO与CaSO4在900℃反应后,固体的物质的量分数与n(CaSO4)/n(CO)的关系图。
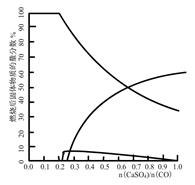
当n(CaSO4)/n(CO)>0.25时,产生对环境影响的气体是 ,你的理由 。
参考答案:(1) (每个2分,共4分)
(每个2分,共4分)
(2)冷凝(2分,答案合理即给分)
(3)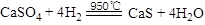 (2分)。
(2分)。
SO2(2分)。当n(CaSO4)/n(CO)>0.25时,反应发生了反应②(2分,答案合理即给分))
本题解析:(1)用煤作燃料时,需要先用H2O或CO2将煤转化为燃料气,其中H2含量较多的原因是焦炭含量大,与水反应生成水煤气: ;(2)水蒸气遇冷液化,故燃料反应的气体产物主要是H2O和CO2通过冷凝分离出水,并回收CO2;(3)CaSO4是一种载体, CaSO4与H2反应的化学方程式
;(2)水蒸气遇冷液化,故燃料反应的气体产物主要是H2O和CO2通过冷凝分离出水,并回收CO2;(3)CaSO4是一种载体, CaSO4与H2反应的化学方程式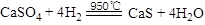 ;(4)CO与CaSO4在900℃反应后,固体的物质的量分数与n(CaSO4)/n(CO)的关系图。当n(CaSO4)/n(CO)>0.25时,产生对环境影响的气体是反应发生了反应②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g)。
;(4)CO与CaSO4在900℃反应后,固体的物质的量分数与n(CaSO4)/n(CO)的关系图。当n(CaSO4)/n(CO)>0.25时,产生对环境影响的气体是反应发生了反应②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g)。
考点:化学反应能量变化。
本题难度:困难