微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 以含硫铁矿石为原料生产硫酸的工艺流程图如下:
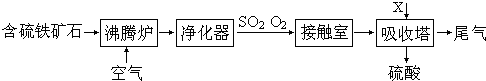
请回答下列问题:
(1)将燃烧含硫铁矿石的化学方程式补充完整:4______+11O2
2Fe2O3+8SO2.
充分煅烧含硫铁矿石Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则含硫铁矿石中硫元素的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)______.
A.?B.?C.?D.
(2)接触室中发生反应的化学方程式是______.
某温度下,进入接触室内SO2和O2的物质的量比为1:1,反应达到平衡时,压强减少,则SO2的转化率为______.
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)______.
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔用于吸收SO3气体的X物质是______(写名称).
已知每240g?SO3气体与H2O化合放出390.9kJ的热量,该反应的热化学方程是______.
(5)排出的尾气SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是______.
参考答案:(1)铁矿石又叫黄铁矿主要含有FeS2,利用FeS2和氧气反应制取二氧化硫气体;根据化学方程式铁矿石中的硫元素转化为二氧化硫,由硫元素守恒可计算硫元素在铁矿石中的含量,利用固体变化计算;
4FeS2+11O2?高温?.?2Fe2O3+8SO2? 固体质量减轻
8×64△m=512-352=160?
?m(SO2)? ?(?W-m)g
?m(SO2)=165(W-m)g,
n(SO2)=120(W-m)mol,
硫铁矿石中硫元素的质量分数=n(SO2)×32g/molw×100%=8(W-m)5W;
故答案为:(1)FeS2;D?
(2)接触室主要是利用催化剂把二氧化硫在催化剂表面氧化为三氧化硫所以化学方程式为2SO2+O2催化剂
本题解析:
本题难度:一般
2、选择题 当分子式为CxHyOz的有机物1mol在O2完全燃烧,产生CO2和水蒸气的体积相等,消耗O2 3.5mol,则该有机物中x、y的值分别为
A.1,2
B.2,4
C.3,6
D.4,8
参考答案:C、D
本题解析:据题意,y=2x,所以该有机物分子式可写为:CxH2xOz,则有:x+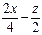 =3.5,解之
=3.5,解之
本题难度:简单
3、填空题 某非金属单质A经如下图所示的过程转化为含氧酸D,已知D为强酸,请回答:

(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体。
①写出A的原子结构示意图:________________
②把B通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀化学式为:
_______________________
③D的浓溶液在加热的条件下可与Cu反应,该反应的化学方程式为:______________
(2)若A在常温下为气体,C是红棕色气体。
①写出A单质的电子式______________。
②C→D的反应中氧化剂与还原剂物质的量之比为:______________
③写出A与H2反应产物的结构式:______________
参考答案:(1)①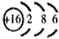 ;②BaSO4;③Cu+2H2SO4
;②BaSO4;③Cu+2H2SO4 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)① ;②1 :2;③
;②1 :2;③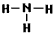
本题解析:
本题难度:一般
4、选择题 在Cu+2H2SO4(浓)=CuSO4+SO2+2H2O的反应中,浓H2SO4的作用是( )
A.酸性
B.还原性
C.氧化性
D.氧化性和酸性
参考答案:在Cu+2H2SO4(浓)=CuSO4+SO2+2H2O的反应中,S元素化合价由+6价降低到+4价,则浓H2SO4起到氧化剂的作用;
生成物有CuSO4,说明浓硫酸还起到酸的作用,生成盐.
故选D.
本题解析:
本题难度:简单
5、选择题 下表中实验操作能达到实验目的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A.碳碳双键、醛基均能被高锰酸钾氧化;
B.溴不易溶于水,但易溶于苯;
C.油脂皂化反应后的混合溶液中加入氯化钠,发生盐析;
D.溴乙烷与氢氧化钠溶液共热发生水解,应先加酸中和,再滴加硝酸银溶液.
解答:A.因碳碳双键、醛基均能被高锰酸钾氧化,则向丙烯醛中滴加酸性高锰酸钾溶液,振荡后溶液褪色,不能确定含有碳碳双键,故A错误;
B.溴不易溶于水,但易溶于苯,则向混有少量苯酚的苯中滴加溴水,因三溴苯酚与苯互溶,且苯中混有溴,不能除去杂质,故B错误;
C.油脂皂化反应后的混合溶液中加入氯化钠,发生盐析降低高级脂肪酸钠的溶解度,所以搅拌、静置、过滤后分离出高级脂肪酸钠,故C正确;
D.溴乙烷与氢氧化钠溶液共热发生水解,应先加酸中和,再滴加硝酸银溶液,才能检验水解产生的溴离子,故D错误;
故选C.
点评:本题考查实验方案的评价,熟悉有机物的官能团及性质、卤代烃的水解、皂化反应、有机物的除杂等即可解答,选项A为解答的易错点,题目难度中等.
本题难度:简单