微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
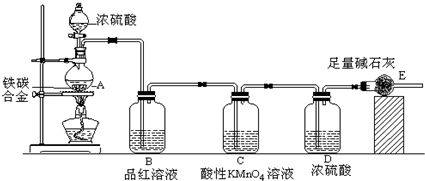
(1)m?g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下碳与浓硫酸不反应;②______.
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式______.
(3)B中的现象是:______;C的作用是:______.
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b?g.则铁碳合金中铁的质量分数为______?(写表达式).
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:______.
(6)本套装置在设计上存在缺陷,其中导致测得铁的质量分数偏低的是(答一条即可)______.
参考答案:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象,
故答案为:常温下Fe遇浓硫酸发生钝化;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,反应方程式为C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;
C装置的作用为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
故答案为:品红溶液褪色;除尽反应产物中的SO2气体;
(4)E增重b?g为二氧化碳的质量,根据碳元素守恒可知合金中碳元素的质量为1244bg,合金中铁的质量为mg-1244bg=(m-311b)g,故铁的质量分数(m-311b)gmg=11m-3b11m,
故答案为:11m-3b11m;
(5)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,铁元素的质量增大,质量分数增大,
故答案为:装置内的CO2难以赶尽,导致E质量增重偏小;
(6)由装置图可知,SO2不一定能全部被品红KMnO4除去,E中碱石灰会吸收空气中的CO2、H2O等,
故答案为:SO2不一定能全部被品红KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O等.
本题解析:
本题难度:一般
2、填空题 硫酸是工业生产中最为重要的产品之一。
(1)工业上制硫酸主要分为____、____、____三个阶段。
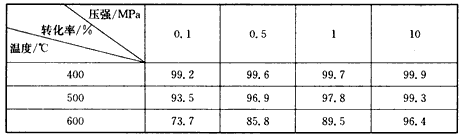
(2)下表是第二阶段反应的有关实验数据,请选择最合适的生产条件
____________、_____________
(3)现在欲提高反应速率和SO2的转化率,下列措施可行的是_______。
A.向装置中通入氮气且保持体积不变
B.向装置中通入氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(4)硫酸生产的尾气中含有少量SO2,可用石灰水吸收后,再用硫酸处理。此过程 涉及的化学反应方程式为___________________、____________________。
(5)若进入第二阶段设备前气体的体积分数分别为:SO2 7%、O2 11%、N2 82%。 现有100体积这样的混合气体在反应后变为96.7体积,则反应后混合气体中N2和SO3的体积比为____________,此时SO2的转化率为__________
参考答案:(1)造气;催化氧化;吸收
(2)400℃;0.1MPa(或常压)
(3)B
(4)SO2+Ca(OH)2=CaSO3↓++H2O;CaSO3+H2SO4=CaSO4+SO2↑+H2O
(5)410:33(或82:6.6);94. 3%
本题解析:
本题难度:一般
3、选择题 由以下五种基团两两结合而形成的化合物,能与NaOH溶液反应的共有(? )
①—CH3?②—OH?③—C6H5④—CHO?⑤—COOH
A.3种
B.4种
C.5种
D.6种
参考答案:D
本题解析:能与NaOH溶液反应的物质有酸类,包括羧酸和无机酸、酚类。将所给基团交叉组合,考查其结构和种类:
①⑤组合为CH3COOH;②⑤组合为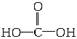 ,即H2CO3,是无机酸;②③组合为C6H5OH,为苯酚;②④组合为
,即H2CO3,是无机酸;②③组合为C6H5OH,为苯酚;②④组合为 ,即HCOOH,是甲酸;③⑤组合为C6H5COOH,为苯甲酸;④⑤组合为
,即HCOOH,是甲酸;③⑤组合为C6H5COOH,为苯甲酸;④⑤组合为 。归纳上述情况,共有6种。
。归纳上述情况,共有6种。
本题难度:简单
4、简答题 某兴趣小组在研究性学习中设计了如下实验来探究Fe和H2SO4反应的过程,装置如下图所示.

①在烧瓶中加入浓硫酸.
②将提拉式铁丝插入溶液中,观察到有少量气泡,后停止的现象.
③加热烧瓶至有大量气体产生时停止加热,品红溶液颜色褪去,烧瓶中溶液变为棕黄色.
④一段时间后KMnO4溶液颜色不再变浅,但NaOH?溶液中仍有气体放出,在导管口处可点燃此气体,烧瓶中液体变为浅绿色
根据以上实验回答:
(1)由步骤②的现象可得出的结论是:______
(2)在步骤③中,品红溶液褪色的原因是______
(3)写出步骤④中,使溶液变为浅绿色的可能的原因是(用离子方程式表示)____________
(4)若1g氢气燃烧生成液态水放出142.9KJ热量,则氢气的燃烧热的热化学方程式是:______
(5)若在反应中铁丝质量减少a克,并收集到bL可燃性气体(标准状况下假设无体积损失),则在反应过程中产生的使品红溶液褪色的气体的质量是______(用含a、b数学表达式表示)
参考答案:(1)常温下将Fe丝插入硫酸中会有气泡产生,说明发生了反应,但一会儿后即停止,说明Fe在硫酸中发生了钝化,阻止了反应的进一步进行,
故答案为:在常温下铁在浓硫酸中发生钝化;
(2)Fe与浓H2SO4反应可能是浓H2SO4强氧化性或是发生置换反应生成H2,则实验现象品红溶液褪色说明产生的是SO2气体,故答案为:生成的二氧化硫具有漂白性;
(3)溶液变为浅绿色说明产生了Fe2+,一种可能是Fe与H2SO4反应生成FeSO4,也存在Fe3+离子转化为Fe2+,故答案为:Fe+2?H+=Fe2++H2,Fe+2Fe3+=3Fe2+;
(4)1g氢气燃烧生成液态水放出142.9KJ热量,则2g氢气即1mol氢气燃烧生成液态水放出285.8KJ的热量,故答案为:H2(g)+12O2(g)=H2O(l)△H=-285.8KJ/mol;
(5)收集到bL可燃性气体氢气,根据化学方程式Fe+2H+=Fe2++H2可以知道消耗金属铁的物质的量为b22.4mol,则和三价铁反应消耗金属铁的物质的量为(a56-b22.4)mol,该物质的量和生成二氧化硫的量相等,所以生成二氧化硫的质量为64(a56-b22.4)g,故答案为:64(a56-b22.4).
本题解析:
本题难度:一般
5、选择题 对下列事实的解释或说法错误的是( )
A.配制一定体积的物质的量浓度溶液,定容时仰视,会使浓度偏低
B.盛装水玻璃和氢氧化钠溶液的试剂瓶,都不能使用磨口玻璃塞
C.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性
D.常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性
参考答案:A、配制一定体积的物质的量浓度溶液,定容时仰视,导致所配溶液的体积偏大,使所配浓度偏低,故A正确;
B、水玻璃是硅酸钠水溶液,玻璃成分含有二氧化硅,在磨口呈处接触面积增大,氢氧化钠与二氧化硅反应生成硅酸钠,硅酸钠溶液是矿物胶,使瓶子和瓶塞粘起来打不开,故装水玻璃和氢氧化钠溶液的试剂瓶,都不能使用磨口玻璃塞,故B正确;
C、蔗糖分子中不含水,加入浓硫酸后出现发黑现象,是浓硫酸把蔗糖分子中的H原子与O原子按2:1结合成水而脱掉,体现浓硫酸的脱水性,不是吸水性,故C错误;
D、Al在浓硝酸中被氧化物一层致密的氧化物保护膜,发生钝化现象,阻止内部金属继续反应,故浓硝酸可用铝罐来贮存,体现浓硝酸的强氧化性,故D正确;
故选C.
本题解析:
本题难度:一般