微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中,各关系式正确的是()
A.等浓度、等体积的NaOH 和二元弱酸H2A 混和溶液中:
c(Na+) + c(H+) =c(HA-) + c(OH-) + c(A2-)
B.1 L 0.1 mol?L-1 CuSO4·(NH4)2SO4·6H2O 的溶液中:
c(SO42—) >c(NH4+)>c(Cu2+)>c(H+)>c(OH—)
C.已知两种弱酸HA、HB 的电离平衡常数Ka(HA)>Ka(HB),常温下0.1 mol?L-1的HA、HB、NaA、NaB 溶液中:pH(NaA)>pH(NaB)>pH(HA)>pH(HB)
D.物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合后的溶液中:
3c(H2CO3)+2c(H+)+c(HCO3—)=2c(OH—)+c(CO32—)
参考答案:BD
本题解析:
正确答案:BD
A.不正确,由电荷守恒,等浓度、等体积的NaOH 和二元弱酸H2A 混和溶液中:
c(Na+) + c(H+) =c(HA-) + c(OH-) + 2c(A2-)
B.正确,1 L 0.1 mol?L-1 CuSO4·(NH4)2SO4·6H2O 的溶液中:2mol?L-1c(SO42—)、NH4+要水解,c(NH4+)<2mol?L-1、Cu2+要水解,c(Cu2 +)<1mol?L-1,各离子浓度顺序为
c(SO42—) >c(NH4+)>c(Cu2+)>c(H+)>c(OH—)
C.不正确,已知两种弱酸HA、HB 的电离平衡常数Ka(HA)>Ka(HB),常温下0.1 mol?L-1的HA、HB、NaA、NaB 溶液中:pH(NaB)>pH(NaA)>pH(HB)>pH(HA)
D.正确,由电荷守恒和物料守恒的计算式,消去Na+的浓度,即可。物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合后的溶液中:
电荷守恒
c(Na+) + c(H+) =c(HCO3―) + c(OH-) +2 c(CO32-)
物料守恒
2c(Na+)=3 c(HCO3―) + 3c(CO32-)+3c(H2CO3)
消去c(Na+)可得
3c(H2CO3)+2c(H+)+c(HCO3—)=2c(OH—)+c(CO32—)
本题难度:简单
2、选择题 能使水的电离平衡右移,且水溶液显酸性的粒子是()
A.H+
B.OH-
C.Al3+
D.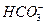
参考答案:C
本题解析:Al3+、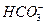 水解促使水的电离,平衡右移,Al3+水解呈酸性,
水解促使水的电离,平衡右移,Al3+水解呈酸性,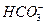 水解呈碱性。
水解呈碱性。
本题难度:简单
3、选择题 下列离子因水解相互促进而不能共存的是()
A.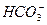 、Na+、Cl-、OH-
、Na+、Cl-、OH-
B.Al3+、Na+、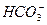 、
、
C.H+、Fe2+、 、Cl-
、Cl-
D.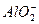 、K+、
、K+、 、Al3+
、Al3+
参考答案:BD
本题解析:解决本题的关键是判断溶液中是否同时存在弱酸的酸根和弱碱的阳离子。A选项中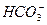 与OH-因发生复分解反应不能大量共存。B选项中Al3+与
与OH-因发生复分解反应不能大量共存。B选项中Al3+与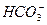 因相互促进水解而不能大量共存:Al3++3
因相互促进水解而不能大量共存:Al3++3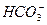 ====Al(OH)3↓+3CO2↑。C选项中Fe2+与H+、
====Al(OH)3↓+3CO2↑。C选项中Fe2+与H+、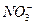 因发生氧化还原反应不能大量共存。D选项中Al3+与
因发生氧化还原反应不能大量共存。D选项中Al3+与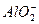 因相互促进水解不能大量共存:Al3++3
因相互促进水解不能大量共存:Al3++3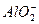 +6H2O====4Al(OH)3↓。
+6H2O====4Al(OH)3↓。
本题难度:简单
4、选择题 常温下,下列各溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.将pH=6的H2SO4稀释1000倍后,c(H+)="2" c(SO42-)
C.浓度分别为0.1 mol·L-1和0.01 mol·L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍
D.NaA溶液的pH=8,c(Na+)-c(A-) ="9" .9×10-7 mol·L-1
参考答案:D
本题解析:A:质子守恒为:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3);B:将pH=6的H2SO4溶液中:c(H+)= 10—6 mol/L, c(SO42-)= 10—6/2 mol/L, 稀释1000倍后,考虑到水的电离,c(H+)= 10—7 mol/L,而c(SO42-)= 10—9/2 mol/L,故二者的密度比为200:1;C:0.01 mol·L-1的CH3COOH溶液相当于将0.1 mol·L-1的CH3COOH溶液稀释十倍,稀释促进水的电离,导致稀释后的c(CH3COO-)多于原溶液的1/10;D:由电荷守恒可知:NaA溶液中c(Na+)+ c(H+)= c(A-)+ c(OH-),将c(H+)=10-8 mol·L-1、c(OH-)=10-6 mol·L-1代入可得c(Na+)-c(A-) ="9" .9×10-7 mol·L-1,故选D
本题难度:一般
5、选择题 下列说法中正确的是?(?)
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
B.常温下,c(NH4+)相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3) <c(Na2CO3)
D.某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液PH=2,则a:b=2:9
参考答案:B
本题解析:在稀溶液中c(H+)与c(OH-)的乘积是个定值,不可能同时下降或升高,A项错误;Fe2+的水解抑制NH4+的水解,CO32-的水解促进NH4+的水解,所以等浓度的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液c(NH4+)②>①>④>③,因此,c(NH4+)相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、?④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③,B项正确;根据越弱越水解可知浓度相同的CH3COONa、NaHCO3和Na2CO3三种溶液的pH为:Na2CO3>NaHCO3>CH3COONa,因此pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)>c(NaHCO3)>c(Na2CO3),C项错误;pH=11的NaOH溶液c(OH-)=10-2mol/L,pH=1的稀硫酸c(H+)=10-1 mol/L,混合后pH=2则有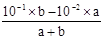 =10-2,则a:b=9:2,D项错误。答案选B。
=10-2,则a:b=9:2,D项错误。答案选B。
点评:本题综合性强,难度大,主要考查学生对知识的分析能力和运用能力。
本题难度:一般