微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,分别以高锰酸钾、氯酸钾和过氧化氢为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
A.1:1:1
B.4:3:2
C.2:3:1
D.2:2:1
参考答案:D
本题解析:
本题难度:简单
2、计算题 由铜片、锌片和200mL稀硫酸组成的原电池中,当铜片上放出3.36L(标状况)气体时(锌片上无气体产生),硫酸恰好反应完.
计算:
(1)产生这些气体消耗的金属是哪一种,消耗的质量是多少;
(2)有多少电子通过了导线;
(3)硫酸溶液的物质的量浓度是多少.
参考答案:(1)锌;9.6g
(2)0.3mol
(3)0.75mol/L
本题解析:
本题难度:一般
3、选择题 取5.06g 由等物质的量的NaBr 和NaI 组成的混合物样品溶于水,然后通入224mL(标准状况下)Cl2 充分反应,则被氧化的Br-的物质的量是
[? ]
A.0
B.0.01mol
C.0.02mol
D.0.04mol
参考答案:A
本题解析:
本题难度:简单
4、填空题 过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把
CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下
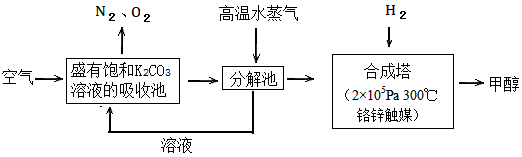
(1)写出吸收池中主要反应的离子方程式_________________;在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式
________________。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括________。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式________________。当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
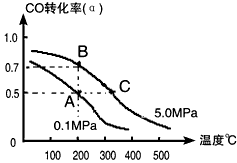
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数
K=__________;此时在B点时容器的体积VB________10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是______________(答出两点即可)。
参考答案:(1)CO32-+ CO2+H2O==2HCO3-;CO2(g)+3H2(g) ==CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
(2)高温水蒸气
(3)CH3OH+8OH--6e-==CO32-+6H2O;1.2mol
(4)①1(L/mol)2;小于;②大于;③降温、加压、将甲醇从混合体系中分离出来(任意两点即可)
本题解析:
本题难度:一般
5、简答题 已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO.如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.Fe3+
B.MnO4-
C.Cl2
D.HNO3
参考答案:由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;
A、1molFe3+→Fe2+得1mole-,
B、1molMnO4-→Mn2+得5mole-,
C、1molCl2→2Cl-得2mole-,
D、1molHNO3→NO得1mole-;
显然B中1mol氧化剂得电子最多,生成的I2就最多,
故选B.
本题解析:
本题难度:一般