微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 实验室用NaCl固体配制1mol/L的NaCl溶液500mL,回答下列问题:
(1)请写出该实验的实验步骤:①计算,②称量,③______,④冷却,⑤______,⑥洗涤,⑦定容,⑧摇匀.用托盘天平称量样品时,若指针偏向右边,则表示______(填“左盘”或“右盘”)重.
(2)所需主要仪器为:托盘天平、药匙、500mL容量瓶、胶头滴管、______.
(3)从配制好的溶液中取出50mL,其中NaCl的物质的量浓度为______.
参考答案:(1)配制1mol/L的NaCl溶液500mL的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等;使用托盘天平时,药品放在左盘,砝码放在右盘,若指针偏向右边,说明右边的砝码较重,
故答案为:溶解;移液(转移);右盘;
(2)配制500mL 1mol/L的NaCl溶液使用的仪器为:托盘天平、药匙、500mL容量瓶、胶头滴管、烧杯、玻璃棒,还缺少烧杯和玻璃棒;
故答案为:烧杯、玻璃棒;
(3)配制好的溶液中取出50mL,由于溶液是均一的,所以NaCl的物质的量浓度还是1mol/L,
故答案为:1mol/L.
本题解析:
本题难度:一般
2、选择题 一定量的14%的KOH溶液,若将其蒸发掉100g水后,其质量分数为28%,体积为125mL,则浓缩后的KOH的物质的量浓度为( )
A.2.2mol/L
B.4mol/L
C.5mol/L
D.6.25mol/L
参考答案:设原KOH溶液的质量为x,则
x×14%=(x-100)×28%,
解得x=200g,
KOH的质量为200g×14%=28g,
则n=28g56g/mol=0.5mol,
所以浓缩后的KOH的物质的量浓度为0.5mol0.125L=4mol/L,
故选B.
本题解析:
本题难度:简单
3、填空题 (10分)摩尔质量是指单位物质的量的物质所含有的质量。
(1)已知NH3的相对分子质量为17,则NH3的摩尔质量为________。
(2)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为________。
(3)已知一个铁原子的质量为b g,则铁的摩尔质量为________。
(4)36g水所含电子的物质的量为________。
(5)配制250 mL 0.2 mol/L NaOH溶液需NaOH质量为________
参考答案:(1)17 g/mo;(2) 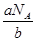 g/mol (3)bNA g/mol ;(4)20mol;(5)2g。
g/mol (3)bNA g/mol ;(4)20mol;(5)2g。
本题解析:(1)已知NH3的相对分子质量为17,则NH3的摩尔质量为17 g/mol;(2)对于同一物质来说,质量越大,物质内的分子个数就越多,设该物质的摩尔质量是M,NA为阿伏加德罗常数,已知a g某气体中含分子数为b,M:a=NA:b,所以M=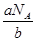 (g/mol),(3)一个铁原子的质量为b g,则NA个铁原子的质量是bNAg,所以Fe的摩尔质量为bNA g/mol; (4)由于水的摩尔质量是18g/mol,所以36g水的物质的量是2mol,一个水分子中含有10个电子,所以2mol的水分子中所含电子的物质的量为20mol;(5)n(NaOH)="C·V=0.25L" ×0.2 mol/L =0.05mol,需NaOH质量为m=n·M=0.05mol×40g/mol=2g。
(g/mol),(3)一个铁原子的质量为b g,则NA个铁原子的质量是bNAg,所以Fe的摩尔质量为bNA g/mol; (4)由于水的摩尔质量是18g/mol,所以36g水的物质的量是2mol,一个水分子中含有10个电子,所以2mol的水分子中所含电子的物质的量为20mol;(5)n(NaOH)="C·V=0.25L" ×0.2 mol/L =0.05mol,需NaOH质量为m=n·M=0.05mol×40g/mol=2g。
考点:考查物质的质量、摩尔质量、微粒数、物质的量浓度的有关计算的知识。
本题难度:一般
4、选择题 某盐的混合物中仅含三种离子,其中0.45mol Mg2+,0.3mol Cl-,则SO42-的物质的量为( )
A.0.1mol
B.0.3mol
C.0. 5mol
D.0.7mol