微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化,如下图所示,各条曲线与溶液中离子数目的大致对应关系描述正确的是( )
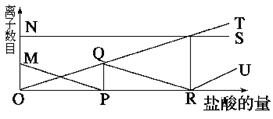
A.NS:K+; MP:H+; QR:C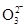 ; OT:HC
; OT:HC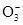 ; RU:Cl-
; RU:Cl-
B.NS:K+; MP:C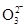 ; OQR:HC
; OQR:HC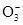 ; OT:Cl-; RU:H+
; OT:Cl-; RU:H+
C.NS:K+; MP:Cl-; QR:H+; OT:HC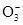 ; RU:C
; RU:C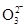
D.NS:K+; MP:H+; OQR:Cl-; OT:C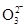 ; RU:HC
; RU:HC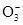
参考答案:B
本题解析:由于碳酸钾和盐酸的反应是分步进行的,方程式是CO32-+H++HCO3-、HCO3-+H+=H2O+CO2↑。再反应过程中,钾离子的数目是不变的,而氯离子的数目则是逐渐增加的,因此正确的答案选B。
本题难度:一般
2、选择题 下列表示对应化学反应的离子方程式正确的是
A.用氨水吸收废气中氮的氧化物:NO+NO2+2OH-═2N+H2O
B.用FeCl3溶液刻蚀铜电路板:Cu+Fe3+═Cu2++Fe2+
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HC
D.0.01?mol?L -1 NH4Al(SO4)2溶液与0.02?mol?L-1? Ba(OH)2溶液等体积混合:N+Al3++2S+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O
参考答案:D
本题解析:分析:A.一水合氨为弱电解质,在离子反应中应保留化学式;
B.电荷不守恒;
C.反应生成碳酸钙和HClO;
D.NH4Al(SO4)2、Ba(OH)2以1:2反应,生成硫酸钡、氢氧化铝、水.
解答:A.用氨水吸收废气中氮的氧化物的离子反应为NO+NO2+2NH3.H2O═2NH4++2NO2-+2H2O,故A错误;
B.用FeCl3溶液刻蚀铜电路板的离子反应为Cu+2Fe3+═Cu2++2Fe2+,故B错误;
C.漂白粉溶液在空气中失效的离子反应为Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓,故C错误;
D.0.01?mol?L -1NH4Al(SO4)2溶液与0.02?mol?L-1Ba(OH)2溶液等体积混合的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,选项D为解答的难点,注意氢氧化铝不能溶于弱碱,题目难度不大.
本题难度:困难
3、选择题 在无色酸性溶液中,能大量共存的是
A.NO3-、I-、Na+、Cl-
B.NO3- 、S2-、Cu2+、 K+
C.Fe2+、OH-、SO32-、Na+
D.NH4+、Cl-、Na+、Ba2+
参考答案:D
本题解析:
本题难度:困难
4、选择题 向10mL 0.1mol·L-1?NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是? (? )
A.x=10时,溶液中有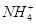 、
、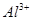 、
、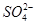 ,且
,且
B.x=10时,溶液中有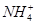 、
、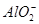 、
、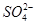 ,且
,且
C.x=30时,溶液中有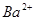 、
、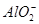 、
、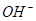 ,且
,且
D.x=30时,溶液中有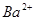 、
、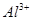 、
、 ,且
,且
参考答案:A
本题解析:
为了方便计算,可以把溶液的体积都扩大100倍,1000,mL 0.1mol·L-1?NH4Al(SO4)2溶液中含有0.1molNH4+ ,0.1mmolAL3+,0.2mmolSO42-,1000ml等浓度Ba(OH)2溶液有0.1mol Ba2+,0.2molOH-,混合后硫酸钡沉淀,剩余0.1mol SO42-。氢氧化铝沉淀,剩余AL3+,所以A答案对。由于氢氧根离子的物质的量小于AL3+3倍,所以溶液中还含有AL3+,没有 ,故B错
,故B错
同理,当Ba(OH)2体积扩大3倍时,溶液中0.3mol Ba2+,0.6molOH-,混合后,剩余0.1mol Ba2+
,生成了偏铝酸根,故C、D错。3+与OH-反应关系式
点评:本题难度大,但是只要将两种溶液中所含的离子的物质的量全部都计算出来,根据相应的化学方程式序数关系,即可计算出溶液中存在哪些离子。
本题难度:一般
5、计算题 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为多少?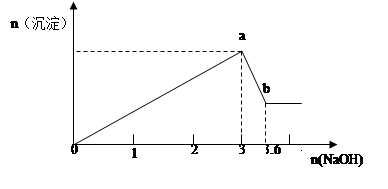
参考答案:FeCl3、AlCl3的物质的量浓度各为4mol/L、6mol/L(要写出规范的计算过程)
本题解析:由Fe3+ + 3OH- = Fe(OH)3↓? Al3+ + 3OH- =Al(OH)3↓得当所有Fe3+和 Al3+都沉淀完全时,,达到最大沉淀量a,消耗OH-3mol,即FeCl3、AlCl3共1mol
继续加NaOH,Al(OH)3逐渐溶解,Al(OH)3 + OH- =AlO2- +H2O
消耗OH-共0.6mol。所以可以由原子守恒得出AlCl3的物质的量为0.6mol,所以FeCl3物质的量为0.4mol。
c(FeCl3)=n/V=0.4mol/0.1L=4mol/L,c(AlCl3)=n/V=0.6mol/0.1L=6mol/L。
点评:在此总结一下对于图象问题的分析方法:(1)认清坐标系,搞清纵、横坐标所代表的意义。(2)看清起点、拐点、终点,看清曲线的变化趋势,并弄清楚各点的物理意义。
本题难度:一般