微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 下表为元素周期表的一部分;a、b、c…为部分元素.回答下列问题:
(1)请写出上述元素d3+的核外电子排布式______;
(2)b的一种氧化物与a、g形成的化合物发生反应可产生气体,请写出该反应的化学方程式______;
(3)请比较c、e、f三种元素的电负性由大到小的顺序______(写元素符号);此三种元素的第一电离能由大到小的顺序______(写元素符号)
(4)e、j两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、g三种元素形成的化合物反应的离子方程式______.
参考答案:(1)由元素在周期表中的位置可知,d为Fe元素,原子序数为26,则Fe3+的核外电子排布式的1s222s2p63s23p63d5,故答案为:1s222s2p63s23p63d5;
(2)根据元素周期表的结构 ,a是H,b是Na,g是O,过氧化钠和水之间反应生成氢氧化钠和氧气,即2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑,;
(3)根据元素周期表的结构,f是C,c是Mg,e是Al,元素原子的得电子能力越强,则电负性越大,所以C>Al>Mg,故答案为:C>Al>Mg;
(4)根据元素周期表的结构,a是H,c是Mg,e是Al,j是Ge,两种元素的最高价氧化物对应的水合物的化学性质相似,e元素最高价氧化物氧化铝对应的水合物氢氧化铝与a、c、g三种元素形成的化合物反应
本题解析:
本题难度:一般
2、选择题 下列关于卤族元素由上到下性质递变的叙述,正确的是
[? ]
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强
④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③
B.②③④
C.②④⑤
D.①③⑤
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列物质中碱性最弱的是( )
A.氢氧化钠
B.氢氧化镁
C.氢氧化铝
D.氢氧化钙
参考答案:根据金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,则可知金属活动性大小为:Ca>Na>Mg>Al,所以碱性:氢氧化钙>氢氧化钠>氢氧化镁>氢氧化铝,故C正确;
故选C.
本题解析:
本题难度:一般
4、填空题 W、X、Y、Z是原子序数依次增大的同一短同期的元素,W、X是金属元素,Y、Z是非金属元素。回答下列问题:
(1)W、X对应的最高价氧化物的水化物可以反应生成盐和水,该反应的离子方程式为_____________。
(2)X的硝酸盐的水溶液显____性,用离子方程式解释原因________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为________________。
(4)W、X、Y、Z四种元素的简单离子的半径由大到小的顺序是:____>____>____>_____。(填离子符号)
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量的水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式_________________ 。
参考答案:(1) Al(OH)3 +OH- == AlO2- +2H2O
(2)酸;Al3++3H2O 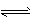 Al(OH)3 +3H+
Al(OH)3 +3H+
(3)SO2+Cl2+2H2O==H2SO4+2HCl
(4)S2->Cl->Na+>Al3+
(5) Cl2O7(1)+H2O(I)==2HClO4 (aq);△H=-4Q kJ/mol
本题解析:
本题难度:一般
5、选择题 运用元素周期律分析下面的推断,其中推断错误的是( )
A.氢氧化铍[Be(OH)2]的碱性比氢氧化镁弱
B.砹(At)为有色固体,HAt不稳定
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
参考答案:D
本题解析:
本题难度:一般