| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《物质的量》高频试题巩固(2017年最新版)(四)
参考答案:D 本题解析:A.标准状况下, NO是气体,而SO3是固体,当二者的体积相等时含有的微粒数目不同,错误;B.0.1molBr2与足量H2O的反应是可逆反应,不能完全转化,转移的电子数小于0.1NA,而Br2与NaOH反应转移的电子数为0.1NA,因此反应转移的电子数目不相等,错误;C.0.1mol的白磷(P4)中含有0.6mol的共价键,0.1mol的四氯化碳(CCl4)中所含的共价键数均为0.4NA,错误;D.在精炼铜或电镀铜的过程中,当阴极析出铜32g时,n(Cu)=0.5mol,由于Cu是+2价的金属,所以转移电子数均为NA,正确。 本题难度:一般 4、选择题 下列说法正确的是( ) |
参考答案:D
本题解析:摩尔是物质的量单位,A不正确;标准状况下气体摩尔体积约为22.4L/mol,B不正确;用摩尔表示时,一般用化学式表示,C不正确,应该是1molO的质量为16g;根据阿伏加德罗定律可知,选项D正确。
考点:考查物质的量、摩尔以及摩尔体积的有关判断
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固于训练,意在培养学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
5、计算题 (6分)、现有Na2CO3、NaHCO3、NaOH的固体混合物共27.2g,将固体完全溶于水配成溶液后,向该溶液中逐滴加入1mol/L的盐酸。所加入盐酸溶液的体积与产生的CO2气体体积的关系如图所示: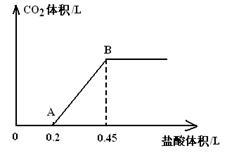
(1)写出OA段所发生反应的离子方程式?;
(2)B点所产生的CO2的体积是_____________L(标准状况);
(3)原混合物中NaOH的质量为_____________g。
参考答案:(1)CO32-+H+=HCO3-?(2)5.6?(3)4.0
本题解析:混合物溶于水后就发生:HCO3-+OH-=CO32-+H2O,溶液中的溶质有三种可能:①Na2CO3和NaHCO3②Na2CO3和NaOH③Na2CO3
若是①,随着向溶液中滴加盐酸:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,则OA段与AB段所消耗盐酸的量后者大(符合题意)
若是②,随着向溶液中滴加盐酸:OH-+H+=H2O、CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,则OA段与AB段所消耗盐酸的量胶者大(不符合题意)
若是③,随着向溶液中滴加盐酸: CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,则OA段与AB段所消耗盐酸的量胶者相等(不符合题意)
设Na2CO3、NaHCO3、NaOH的物质的量分别为xmol、ymol、zmol
则:106x+84y+40z=27.2? x+z=0.2×1? x+y=0.25×1
解得:x="0.1" mol? y="0.15" mol? z=0.1mol
B点所产生的CO2的体积即:0.25×22.4=5.6L
原混合物中NaOH的质量为:0.1×40=4.0g
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《认识晶体》.. | |