微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实与结论相符且正确的是
[? ]
A.100 mL 0.1 mol·L-1 AlCl3溶液中含有Al3+数目为0.01NA (NA代表阿伏加德罗常数)
B.Ksp(BaSO4) =1.07×10-10,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3
C.常温下,pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液pH<7
D.0.1 mol·L-1 Na2CO3溶液中:c(Na+)>c(CO32-)> c(HCO3-)>c(OH-)>c(H+)
参考答案:C
本题解析:
本题难度:一般
2、选择题 对于下列各种溶液中,微粒的物质的量浓度关系表述正确的是( )
A.在25℃100mLNH4Cl溶液中:c?(Cl-)=c?(NH4+)+c?(NH3?H2O)
B.0.1mol?L-1的NaHSO3溶液中:c?(Na+)=c?(HSO3-)+c?(H2SO3)+2c?(SO32-)
C.将0.2mol?L-1NaA溶液和0.1mol?L-1盐酸等体积混合所得碱性溶液中:c?(Na+)+c?(H+)=c?(A-)+c?(Cl-)
D.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
参考答案:A.由NH4Cl及物料守恒可知,在25℃100mLNH4Cl溶液中:c?(Cl-)=c?(NH4+)+c?(NH3?H2O),故A正确;
B.在0.1mol?L-1的NaHSO3溶液中,由物料守恒可知,c?(Na+)=c?(HSO3-)+c?(H2SO3)+c?(SO32-),故B错误;
C.混合所得碱性溶液中,溶液不显电性,由电荷守恒可知,c?(Na+)+c?(H+)=c?(A-)+c?(Cl-)+c?(OH-),故C错误;
D.醋酸电离显酸性,NH4Cl溶液水解显酸性,则25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中都有c(H+)=10-5mol/L,故D错误;
故选A.
本题解析:
本题难度:一般
3、填空题 25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因_____________________(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)_________0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填“>”、“<”或“=”)
(3)求出混合液中下列算式的精确计算结果(填具体数字):c (Na+)-c (A-)=___________mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的
pH_______7 (填“>”、“<”或“=”);
(5)将相同温度下相同浓度的四种溶液:
A.NH3·H2O B.NH4A C.NH4HSO4 D.NH4Cl
按NH4+浓度由大到小的顺序排列______________________(填序号)
参考答案:(1)A-+H2O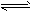 HA+OH-
HA+OH-
(2)>
(3)9.9×10-7
(4)>
(5)CDBA
本题解析:
本题难度:一般
4、填空题
在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH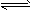 CH3COO-+H+ △H>0
CH3COO-+H+ △H>0
(1)下列方法中,可以使0.10mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是____________。
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOHc.加入稀释至0.010mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)25℃时,该电离平衡的平衡为1.75×10-5。现有:
①0.100.010mol·L-1 CH3COOH溶液 ②0.00100.010mol·L-1 CH3COOH溶液 其c(H+)之比为①:②=______。(提示:进行简化计算,平衡时的c(CH3COOH)可用起始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同)
(3)25℃时,向0.10mol·L-1 CH3COOH溶液中加入一定量固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0mol·L-1,则溶液中c(H+)=________mol·L-1 (计算结果保留小数点后两位有效数字)。溶液中各种离子浓度关系是_________。
参考答案:(1)bcf
(2)10:1
(3)c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
本题解析:
本题难度:一般
5、简答题 A、(1)25℃时0.1mol?L-1HCl溶液的pH=______;
(2)25℃时0.1mol?L-1CH3COONa溶液的pH______7(填“>”、“<”或“=”),
其原因是______(用离子方程式来表示)
(3)将上述两溶液等体积混合,离子浓度大小顺序正确的是______(填序号)
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)?B.c(Na+)>c(Cl-)>c(H+)>c(OH-)
C.c(Na+)=c(Cl-)>c(H+)>c(OH-)?D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
B、在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)
参考答案:A.(1)0.1mol?L-1HCl溶液中c(H+)=0.1mol/L,故pH=-lgc(H+)=-lg0.1=1,
故答案为:1;
(2)CH3COONa属于强碱弱酸盐,醋酸根水解CH3COO-+H2O?CH3COOH+OH-,破坏水的电离平衡,溶液呈碱性,溶液的pH>7,
故答案为:>;CH3COO-+H2O?CH3COOH+OH-;
(3)将0.1mol?L-1HCl与0.1mol?L-1CH3COONa等体积混合,混合后溶液为等浓度的CH3COOH、NaCl.NaCl完全电离,故c(Na+)=c(Cl-),溶液中CH3COOH是弱电解质,部分电离,溶液呈酸性,故c(Cl-)>c(H+)>c(OH-),所以c(Na+)=c(Cl-)>c(H+)>c(OH-),
故答案为:C;
B.Mg(OH)2、Cu(OH)2的结构相 同,Cu(OH)2的溶度积更小,其溶解度更小,加入相同的氨水,Cu2+先沉淀生成Cu(OH)2,反应方程式为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+.
本题解析:
本题难度:一般