微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c?moL/L,则下列关系中不正确的是(溶质用NH3表示)( )
A.ρ=
B.ω=
C.c=
D.ω=
参考答案:A.ρ=mV=VL22.4L/mol×17g/molVL22.4L/mol×17g/mol+1000gρg/ml=17Vρ17V+22400g/ml,故A错误;
B.ω=溶质的质量溶液的质量×100%=VL22.4L/mol×17g/molVL22.4L/mol×17g/mol+1000g×100%=17V17V+22400,故B正确;
C.c=nV=VL22.4L/molVL22.4L/mol×17g/mol+1000gρ×10-3g/L=1000ρV17V+22400mol/L,故C正确;
D.ω═溶质的质量溶液的质量×100%=17g/mol×VL×cmol/LVL×1000×ρ/L=17c1000ρ,故D正确.
故选A.
本题解析:
本题难度:简单
2、计算题 (6分)在加热条件下,用二氧化锰与足量浓盐酸反应,制得氯气0.56L(标准状况)。问:
(1)理论上需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
(3)在反应中,电子转移的数目大约是多少?
参考答案:4HCl()+MnO2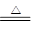 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4mol? 87g? 22.4L
n? m? 0.56L
(1)所以消耗二氧化锰的质量是m=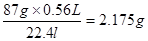
(2)参加反应的氯化氢是n=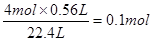
因为被氧化的氯化氢和参加反应的氯化氢是1︰2的
所以被氧化的HCl的物质的量是0.05mol
(3)反应中转移电子是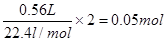
数目是0.05mol×6.02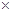 1023/mol=3.01
1023/mol=3.01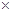 1022
1022
本题解析:考查根据化学方程式进行的有关计算。
本题难度:一般
3、选择题 设NA代表阿伏加德罗常数的值,下列说法不正确的是(? )。
A.阿伏加德罗常数NA是0.012kg12 C中所含的原子数
B.2g氢气所含氢原子数目为NA
C.标况下,22.4L NH3所含的分子数目为NA
D.1 L 1 mo1·L-1 NaCl溶液中所含有的Na+离子数目为NA
参考答案:B
本题解析:A正确,0.012kg12 C中所含的原子数即为阿伏加德罗常数;B错,2g氢气物质的量为1mol,含氢原子数为2NA;C正确,标况下,22.4L NH3的物质的量为1mol,所含的分子数目为NA;D正确,1 L 1 mo1·L-1? NaCl溶液中NaCl的物质的量为1mol,溶液中所含有的Na+离子数目为NA;
本题难度:一般
4、选择题 同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液的体积比是3:2:1,则三溶液中氯离子的物质的量浓度之比为( )
A.3:4:3
B.1:2:3
C.1:1:1
D.6:3:2
参考答案:离子的物质的量浓度=溶质的物质的量浓度×一个溶质化学式中含有离子的个数,所以氯化钠溶液中氯离子的物质的量浓度等于氯化钠的浓度,氯化镁溶液中氯离子的物质的量浓度等于氯化镁物质的量浓度的2倍,氯化铝溶液中氯离子的物质的量浓度是氯化铝浓度的3倍,同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液中氯离子的物质的量浓度之比为1:2:3,与溶液的体积无关,
故选B.
本题解析:
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.3mol NF3与水完全反应生成HF、HNO3和NO,转移电子数2NA
B.22.4L CO2与过量的Na2O2反应,转移的电子数为NA
C.60 g SiO2晶体中含有2 NA个Si-O键
D.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA