| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《水的电离平衡》高频考点特训(2017年练习版)(六)
参考答案:B 本题解析:pH=3的盐酸和c(OH-)=10-3mol·L-1的Ba(OH)2溶液等体积混合,溶液呈中性,故a=d;pH=3的盐酸和c(NH3·H2O)=10-3mol·L-1的氨水等体积混合时恰好完全反应,溶液呈酸性,要使溶液呈中性,氨水的体积要大于盐酸,故b>a;pH=3的盐酸和c(OH-)=10-3mol·L-1的氨水等体积混合时氨水有剩余,PH>7,要使溶液呈中性,氨水的体积要小于盐酸,故a>c;所以b>a=d>c, B项正确。 本题难度:一般 4、选择题 现用pH=3的CH3COOH溶液和pH=11的NaOH溶液各V mL,进行中和滴定,当滴定到pH=7时,锥形瓶内溶液的体积为(滴定前后溶液未稀释、总体积不变): |
参考答案:B
本题解析:V mLpH=3的CH3COOH溶液和pH=11的NaOH溶液V mL混合,醋酸有剩余,PH<7,所以pH=7时,消耗醋酸的体积小于V mL,故锥形瓶内溶液的体积小于2V mL,B正确。
考点:本题考查中和滴定。
本题难度:一般
5、实验题 (14分)某实验小组利用下图所示实验装置,使氢气平缓地通过装有金属钙的硬质玻璃管制取氢化钙,并分析产品的成分及纯度。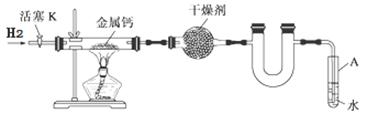
(1)试管A的作用有 ; 。
(2)请将下列制备氢化钙的操作步骤补充完整:
①打开活塞K通入H2;
② ;
③点燃酒精灯,进行反应;
④反应结束后, ;
⑤拆除装置,取出产物。
(3)经分析,产品中只含钙、氢两种元素。取少量产品,小心加入水中,观察到有气泡冒出,滴入一滴酚酞试液,溶液变红。反应的化学方程式可能有CaH2+2H2O=Ca(OH)2+2H2↑、 。
(4)取2.30 g产品溶于蒸馏水,配成500 mL溶液;取25.00 mL该溶液于锥形瓶中,滴入2滴酚酞试液,用0.2500 mol/L 盐酸滴定;三次平行实验,平均消耗盐酸22.00 mL。
①配制溶液所用的玻璃仪器有胶头滴管、烧杯、玻璃棒、量筒、 ;
②判断滴定终点的方法是 ;
③产品中两种成分物质的量之比为 。
参考答案:(14分)
(1)防止反应过程中空气进入反应管(1分);便于观察H2流速(1分)
(2)②收集气体并检验其纯度(2分)
④熄灭酒精灯,待反应管冷却至室温,停止通H2并关闭活塞K(3分)
(3)Ca+2H2O=Ca(OH)2+H2↑(2分)
(4)①500mL容量瓶(1分)②最后一滴盐酸,整个溶液由红色变为无色(1分)③1:10(3分)
本题解析:(1)试管A用液体封了导管口,所以能防止反应过程中空气进入反应管;通过氢气的气泡可以观察H2流速。(2)②因为金属钙容易和空气中的氧气反应,所以需要用氢气排除装置中的空气,所以通入氢气,收集气体并检验其纯度。④反应结束后,为了防止氢化钙被氧化,所以先熄灭酒精灯,待反应管冷却至室温,停止通H2并关闭活塞K。(3)氢化钙能和水反应生成氢氧化钙和氢气,方程式为:Ca+2H2O=Ca(OH)2+H2↑。(4)①配制溶液需要使用500mL容量瓶。②锥形瓶中滴加酚酞,溶液显红色,所以滴定的终点为加入最后一滴盐酸,整个溶液由红色变为无色,且半分钟不变色。③盐酸的物质的量为0.2500×0.02200=0.0055mol,所以原来产品中钙的物质的量为0.0055÷2×500÷25=0.055mol,假设钙的物质的量为xmol,氢化钙的物质的量为ymol,则有x+y=0.05540x+42y=2.30,解x=0.005mol,y=0.05mol,所以二者物质的量比为1:10。
考点:物质的制备,中和滴定,实验数据的处理
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《物质的量》.. | |