|
高考化学知识点总结《化学平衡状态的判断》试题巩固(2017年最新版)(八)
2017-08-06 11:36:45
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2008年,中国人民经受了雪灾、震灾等自然灾害的严峻考验,漫长的灾后重建需要大量的钢铁。高炉炼铁中发生的基本反应为Fe2O3+3CO 2Fe+3CO2,为更快更好的生产出优质钢材,下列措施不可行的是?(?)? 2Fe+3CO2,为更快更好的生产出优质钢材,下列措施不可行的是?(?)?
A.升高温度
B.建容量大的高炉,增大铁矿石的投入量
C.增大CO的浓度
D.将铁矿石粉碎,尽可能用小块的铁矿石
参考答案:B
本题解析:固体铁矿石的多少不影响反应速率,也不影响平衡移动。
本题难度:简单
2、填空题 工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)  ?CH3OH(g)+Q ?CH3OH(g)+Q
(1)能判断反应达到平衡状态的依据是(填字母序号,下同)________。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
| (2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度
| 250℃
| 300℃
| 350℃
| K
| 2.041
| 0.270
| 0.012
|
?
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
(3)要提高CO的转化率,可以采取的措施是________。
a.升温;b.加入催化剂;c.增加CO的浓度;d.加入H2加压;e.加入惰性气体加压;f.分离出甲醇
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。
参考答案:(1)CD
(2)①>?②80%;250℃
(3)df (2分)
(4)选Z,温度要求低,反应速率快。(2分)
本题解析:(1)A.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,错误;B.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,错误;C.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,正确;D.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,正确;故选CD;
(2)①升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,而放出的热量Q>0;
②平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率= n(CO)(反应)/ n(CO)(反应开始)×100%=(1?0.4)mol÷2mol×100%=80%
CO(g)+2H2(g)≒CH3OH(g)单位为mol/L
反应开始(mol/L)? 1? 3?0?
反应(mol/L)? 0.8? 1.6? 0.8
平衡(mol/L)? 0.2? 1.4? 0.8
平衡常数K="0.8" / 0.2(1.4)2?=2.04,所以温度是250℃。
(3)a.该反应是放热反应,升高温度平衡向逆反应方向移动,故错误;b.催化剂对平衡移动无影响,故错误;c.增加CO的浓度,平衡向正反应方向移动,但CO的转化率降低,故错误;d.加入H2加压,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;e.加入惰性气体加压,参加反应的气体压强不变,平衡不移动,故错误;f.分离出甲醇,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;故选df.
(4)因为T1>T2>T3,所以温度越低平衡常数越大,反应物转化率越大,又催化剂同等程度加快反应速率,所以既能在低温下作用又能加快反应速率的催化剂最好选用Z。
本题难度:困难
3、填空题 恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+B(g)?xC?(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol?L-1?s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%.
(1)x=______;
(2)从反应开始到40s达平衡状态,A的平均反应速率为______;
(3)平衡时容器中B的体积分数为______;
(4)该温度下此反应的平衡常数表达式为______数值是______;
(5)下列各项能表示该反应达到平衡状态是______
A.消耗A的物质的量与生成D的物质的量之比为2:1 B.容器中A、B的物质的量?n(A):n(B)=2:1
C.气体的平均相对分子质量不再变化 D.压强不再变化 E.气体密度不再变化
(6)在相同温度下,若起始时c(A)=5mol?L-1,c(B)=6mol?L-1,反应进行一段时间后,测得A的浓度为3mol?L-1,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)______v(逆)(填“大于”“小于”或“等于”).
参考答案:(1)出A的物质的量变化量△n(A)=2mol-1.7mol=0.3mol,△n(C)=0.0225mol?L-1?s-1×10s×2L=0.45mol,根据物质的量变化量之比等于化学计量数之比,则0.3mol:0.45mol=2:x,解得x=3.
故答案为:3.
(2)40s时反应恰好处于平衡状态,此时B的转化率为20%,参加反应的B的物质的量为2mol×20%=0.4mol,由方程式可知,参加反应的A的物质的量为2×0.4mol=0.8mol,故v(A)=0.8mol2L40s=0.01mol?L-1?s-1.
故答案为:0.01mol?L-1?s-1.
(3)平衡时参加反应的B的物质的量为2mol×20%=0.4mol,则:
? ?2A(g)+B(g)?3C?(g)+D(s),
开始(mol):2? 2? 0? 0
变化(mol):0.8? 0.4? ?1.2? 0.4?
平衡(mol):1.2? 1.6? 1.2? 0.4
故平衡时B的体积分数为1.6mol1.2mol+1.6mol+1.2mol×100%=40%
故答案为:40%.
(4)可逆反应2A(g)+B(g)?3C?(g)+D(s)的平衡常数k=c3(C)c2(A)?c(B);
由(3)中计算可知,平衡时A、B、C、D的浓度分别为1.2mol2L=0.6mol/L,1.6mol2L=0.8mol/L,1.2mol2L=0.6mol/L,所以平衡常数k=c3(C)c2(A)?c(B)=0.630.62×0.8=0.75.
故答案为:c3(C)c2(A)?c(B);.
平衡常数指生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
计算出平衡时各组分的浓度,代入平衡常数表达式计算平衡常数.
(5)A.反应自始至终A与D都按物质的量之比2:1进行,不能说明反应到达平衡,故A错误;
B.平衡时A、B的物质的量关系,与反应条件有关,即与物质的转化率有关,平衡时容器中A、B的物质的量?n(A):n(B)可能是2:1,可能不是2:1,不能说明反应到达平衡,故B错误;
C.气体的总的物质的量不变,随反应进行气体的质量减小,气体的平均相对分子质量减小,气体的平均相对分子质量不再变化,说明反应到达平衡状态,故C正确;
D.反应前后气体的物质的量不变,压强自始至终不变化,故D错误;
E.容器的容积不变,随反应进行气体的质量减小,气体密度减小,气体密度不再变化,说明反应到达平衡,故E正确.
故选:CE.
(6)若起始时c(A)=5mol?L-1,c(B)=6mol?L-1,反应进行一段时间后,测得A的浓度为3mol?L-1,则:
? ?2A(g)+B(g)?3C?(g)+D(s),
开始(mol/L):5?6? 0? 0
变化(mol/L):5-3=2?1?3?1?
一段时间(mol/L):3?5? 3? 1
所以浓度商Qc=3332×5=0.6<0.75,反应未达平衡状态,向正反应进行,故v(正)>v(逆).
故答案为:否;大于.
本题解析:
本题难度:简单
4、选择题 某温度下,把3molA和2.5molB混合,盛入容积为2L的容器内,使它们发生反应:
3A(气)+B(气) xC(气)+2D(气) xC(气)+2D(气)
经过5min后达到平衡生成1mol D , 测得C的平均生成速率为0.10mol·L-1·min-1。下列叙述不正确的是(? )?
A.x的值为2
B.B的转化率为20%
C.平衡常数为1/3
D.A的平均消耗速率为0.15mol·L-1·min-1
参考答案:C
本题解析:A.、5min后达到平衡生成1mol D,则v(D)=1mol/2L/5min=0.10mol?L-1?min-1,速率之比等于化学计量数之比,故x:2=0.1:0.1,解得x=2,故A正确;B、5min后达到平衡生成1mol D,由方程式可知参加反应的B为1mol×1/2=0.5mol,故B的转化率为0.5mol/2.5mol×100%=20%,故B正确;C、5min后达到平衡生成1mol D,D的平衡浓度为0.5mol/L,则:
3A(气)+B(气)?2C(气)+2D(气),
开始(mol/L):1.5? 1.25? 0? 0
变化(mol/L):0.75? 0.25? 0.5? 0.5
平衡(mol/L):0.75? 1? 0.5? 0.5
故该温度平衡常数k=(0.52×0.52)/(0.753×1)=4/27,故C错误;D、速率之比等于化学计量数之比,故v(A)="3/2" v(C)=3/2×0.10mol?L-1?min-1=0.15mol?L-1?min-1,故D正确。
本题难度:一般
5、填空题 (15分)
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有?(填字母)。
a.置换反应? b.复分解反应? c.分解反应? d.化合反应
(2)图1中反应①的化学方程式是?。(3分)
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是?(填字母)。
A.升高温度? B.降低温度? C.增大压强
D.减小压强? E.加入催化剂? F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
?mol?L-1?min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
容器编号
| n(甲)
| n(C)
| n (D)
| v正与v逆的关系
| Ⅰ
| 0.20
| 0.10
| 0.20
| v正=v逆
| Ⅱ
| 0.20
| 0.40
| 1.00
| ②?
| Ⅲ
| 0.60
| 1.20
| 0.80
| ③?
|
①若方程式系数为最简整数比,则该温度下的平衡常数K=?
填写表中空格:?②??③?
参考答案:(1) c、d(各1分,写错1个扣1分,扣完2分止)
(2)4NH3+5O2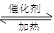 ?4NO + 6H2O(3分) ?4NO + 6H2O(3分)
(3)? B、C (各1分,写错1个扣1分,扣完2分止)
(4)? 0.075(2分)
(5)?①40(2分)?②<(2分)?③>(2分)
本题解析:D为红综色气体,则D是NO2。因此反应③是NO和氧气发生的氧化还原反应,即甲是氧气,C是NO。氧气和B反应生成物也是NO,这说明B是氨气,反应①属于氨的催化氧化,则A是H2O,电解水得到氢气和氧气,属于乙是氢气。
(1)②③分别是分解反应和化合反应,①是氧化还原反应。
(2)氨气发生催化氧化的反应式为4NH3+5O2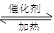 ?4NO + 6H2O ?4NO + 6H2O
(3)反应③的反应式为2NO+O2 2NO2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。 2NO2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。
(4)? 2NO+O2 2NO2 2NO2
起始量(mol)? 2? 1? 0
转化量(mol)? 2x? x? 2x
平衡量(mol)? 2-2x 1-x? 2x
所以有2-2x+1-x+2x=2.55
解得x=0.45mol
所以用甲表示的化学反应速率为
(5)正逆反应速率相等,说明反应达到平衡状态,所以平衡常数为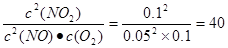 。在Ⅱ 。在Ⅱ
 >40,所以正反应速率小于逆反应速率。在Ⅲ >40,所以正反应速率小于逆反应速率。在Ⅲ
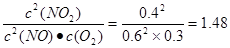 <40,所以正反应速率大于逆反应速率。 <40,所以正反应速率大于逆反应速率。
本题难度:一般
|