微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是
[? ]
A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.加入反应物,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
参考答案:C
本题解析:
本题难度:一般
2、简答题 Ⅰ.下列四支试管中,过氧化氢分解的化学反应速率最大的是______
| 试管 | 温度 | 过氧化氢浓度 | 催化剂
a
室温(25℃)
12%
有
b
水浴加热(50℃)
4%
无
c
水浴加热(50℃)
12%
有
d
室温(25℃)
4%
无
|
Ⅱ.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂
①
10mL2%?H2O2溶液
无
②
10mL5%?H2O2溶液
无
③
10mL5%?H2O2溶液
1mL0.1mol?L-1FeCl3溶液
④
10mL5%?H2O2溶液+少量HCl溶液
1mL0.1mol?L-1FeCl3溶液
⑤
10mL5%?H2O2溶液+少量NaOH溶液
1mL0.1mol?L-1FeCl3溶液
|
(1)实验①和②的目的是______.
(2)写出实验③的化学反应方程式______.
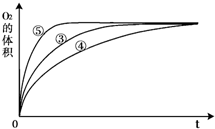
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析如图能够得出的实验结论是______.
参考答案:I.温度越高、浓度越大、使用催化剂都有利于化学反应速率的提高,故答案为:c;
II.(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响,故答案为:探究浓度对反应速率的影响;
(2)双氧水在三氯化铁作用下分解方程式为:2H2O2
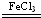
?O2↑+2H2O,故答案为:2H2O2
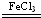
?O2↑+2H2O;
(3)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
本题解析:
本题难度:一般
3、选择题 在一个不导热的密闭反应器中,只发生两个反应:
A(g)+B(g)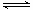 2C(g);△H < 0
2C(g);△H < 0
X(g)+3Y(g)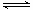 2Z(g);△H > 0
2Z(g);△H > 0
进行相关操作且达到平衡,下列叙述正确的是
A.等压时,通入惰性气体,C的物质的量增大
B.等压时,通入X气体,反应器中温度不变
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入X气体,Y的物质的量浓度增大
参考答案:C
本题解析:A、等压时,通入惰性气体,相当于减小压强,平衡1不移动,平衡2向左移动,该反应逆反应为放热反应,相当于给体系加热,平衡1向左移动,C的物质的量减小;B、等压时,通入X气体,平衡发生移动,一定有能量变化;C、等容时,通入惰性气体,反应气体浓度不变,没有影响;D、等容时,通入X气体,平衡右移,Y的浓度减小。
本题难度:一般
4、选择题 中国锅炉燃烧采用沸腾炉的逐渐增多,采用沸腾炉的好处在于
[? ]
A.增大煤炭燃烧时的燃烧热并形成清洁能源 ?
B.减少炉中杂质气体(如SO2等)的形成?
C.提高煤炭的热效率并减少CO的排放 ?
D.使燃料燃烧充分,从而提高燃料的利用率
参考答案:CD
本题解析:
本题难度:一般
5、简答题 低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=a?kJ?mol-1的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 427 | 700 | 800
平衡常数
9.94
9
b
0.64
|
(1)a______0?(填“<”或“>”).若到达平衡后升高温度,则CO的转化率将______,正反应速率______(填“增大”、“减小”或“不变”).
(2)若在427℃时进行,且CO、H2O的起始浓度均为0.01mol/L,在该条件下,CO的最大转化率为______.
(3)700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | H2O/mol
0
1.20
0.60
t1
0.80
t2
0.20
|
保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=______mol;b=______.
参考答案:(1)由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,则正反应为放热反应,故a>0,
平衡向逆反应移动,CO的转化率减小,升高温度反应速率加快,故正反应速率增大,
故答案为:>,减小,增大;
(2)到达平衡时转化率最大,令平衡时CO的浓度变化量为x,则:
?CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):0.01? 0.01?0? 0
变化(mol/L):x? x? x? x
平衡(mol/L):0.01-x?0.01-x? x? x
故x×x(0.01-x)×(0.01-x)=9,解得x=0.0075
故CO的转化率为0.0075mol/L0.01mol/L×100%=75%
故答案为:75%;
(3)由表中数据可知,t1时刻,△n(CO)=1.2mol-0.8mol=0.4mol,根据方程式CO(g)+H2O(g)?H2(g)+CO2可知,△n(H2O)=0.4mol,故此时n(H2O)=0.6mol-0.4mol=0.2mol,t2时刻水的物质的量为0.2mol,故t1时刻反应达平衡,
?CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol):1.2? 0.6?0? 0
变化(mol):0.4?0.4? 0.4? 0.4
平衡(mol):0.8? 0.2? 0.4?0.4
故该温度下平衡常数为:0.4×0.40.8×0.2=1
起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,令二氧化碳的物质的量为y,则:
? ?CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol):0.6?1.2?0? 0
变化(mol):y? y?y? y
平衡(mol):0.6-y? 1.2-y? y? y
所以y×y(0.6-y)×(1.2-y)=1,解得y=0.4,
故答案为:0.4,1.
本题解析:
本题难度:一般