微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 影响化学反应速率的因素很多,下列措施能加快化学反应速率的是( )
A.降低反应物浓度
B.降低温度
C.降低压强
D.升高温度
参考答案:A.降低反应物浓度,活化分子数目减少,反应速率减慢,故A不选;
B.降低温度,活化分子百分数减少,反应速率减慢,故B不选;
C.降低压强,活化分子数目减少,反应速率减慢,故C不选;
D.升高温度,活化分子百分数增多,反应速率加快,故D选;
故选D.
本题解析:
本题难度:一般
2、选择题 下列有关推断中,不正确的是
[? ]
事 实?
结 论?
A.
CaCO3+2CH3COOH=(CH3COO)2Ca +CO2↑+H2O
酸性: CH3COOH > H2CO3
B.
氢硫酸(H2S)放置在空气中变浑浊
氧化性:O2>S
C.
Al(OH)3既溶于强酸又溶于强碱
Al元素既有金属性也有非金属性
D.
反应A+2B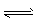 C达平衡后,升高温度,平衡正向移动
C达平衡后,升高温度,平衡正向移动
升高温度,使v正增大、v逆减小
参考答案:D
本题解析:
本题难度:一般
3、填空题 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断________段化学反应速率最快,_______段收集的氢气最多。

(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是 ?,一定时间后反应速率逐渐减慢,其原因是 ?
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是(?)
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸
E.降低温度
参考答案:(1)EF,EF
(2)该反应放 热,体系温度升高,反应速率加快;盐酸浓度不断减小,反应速率减缓。
(3)A.C.
本题解析:(1)图中的斜率越倾斜,其反应的速率越大,所以EF段化学反应速率最快,反应速率越快,收集的氢气就越多,所以EF段收集的氢气最多;(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是该反应放 热,体系温度升高,反应速率加快;一定时间后反应速率逐渐减慢,其原因是盐酸浓度不断减小,反应速率减缓;(3)减缓上述反应的速率,可以通过使反应物的浓度减小,例如加入蒸馏水,或者是加入某些溶液,例如是加入氯化钠溶液,所以答案为A.C。
点评:本题考查了化学平衡,影响化学反应速率的因素的知识,该题有一定的综合性,难度适中,要注意(3)中,BC中的区别,氯化钠不能减缓其反应速率,但是加入的氯化钠溶液却可以稀释反应物的浓度,从而减缓其反应速率。
本题难度:一般
4、选择题 右图为可逆反应A(g)+2B(g) nC(g) (正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强P1、P2的关系正确的是
nC(g) (正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强P1、P2的关系正确的是
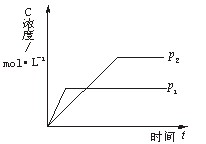
A.P2>P1,n<3
B.P2>P1,n>3
C.P1>P2,n<3
D.P1>P2,n>3
参考答案:D
本题解析:根据图像可知,P1曲线首先达到平衡状态,说明压强是P1大于P2。压强大,但C的浓度小,说明增大压强平衡向逆反应方向移动,即正反应是体积增大的,所以n大于3,答案选D。
本题难度:简单
5、选择题 一定条件下,可逆反应C(s)+CO2(g)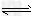 2CO(g)-Q,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的?
2CO(g)-Q,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的?
[? ]
A.①②③④?
B.①③?
C.④② ?
D.①③④?
参考答案:B
本题解析:
本题难度:一般