微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡。触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是?。
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:?。
⑵铝片表面出现的暗红色物质的过程中发生的离子反应方程式是?。用离子方程式解释产生气泡的原因:?。
⑶放出的气体是?,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是?。(写出一点即可)
⑷某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是?。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
⑸除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
选项
| 铝电极
| 电解质
| 负极反应
| 正极反应
|
A
| 正极
| NaOH
| Al-3e-=Al3+
| 2H2O+2e-=2OH-+H2↑
|
B
| 负极
| 稀盐酸
| 2Al-6e-=2Al3+
| 6H++6e-=3H2↑
|
C
| 正极
| 浓硝酸
| Cu-2e--=Cu2+
| 2NO3-+4H+-4e-=2NO2↑+2H2O
|
D
| 负极
| 稀硝酸
| Cu-2e-=Cu2+
| 2NO3-+8H+=2NO↑+4H2O+6e-
|
其中正确的是?,由此推知,金属作电极不仅与本身性质相关,而且与 ________?有关。
参考答案:(15分)⑴C (1分)在硫酸铜溶液中加入铝片,无明显现象,再加入氯化钠(注意:不能加入盐酸),若反应明显加快了,说明上述推断正确。(2分)
⑵2Al+3Cu2+=3Cu+2Al3+;(2分)Al3++3H2O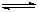 Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O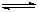 Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑?(2分)
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑?(2分)
(3)氢气(1分)? ①随着反应进行生成铝离子浓度增大,水解程度增大,产生大量H+? ②该反应放热,升高温度反应加快? ③铜与铝构成原电池,加快铝失电子?(3分)
⑷AB?(2分)
⑸B( 2分)?电解质的性质(1分)
2分)?电解质的性质(1分)
本题解析:略
本题难度:一般
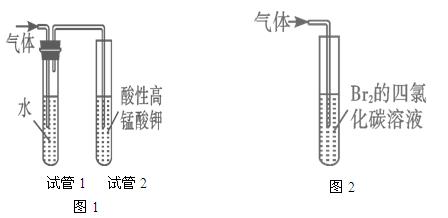
2、实验题 (16分).某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
Ⅰ.装置B的作用??。
装置D的作用??。
Ⅱ.如何检验反应中是否有O2生成
??。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:??。
(1)假设2的反应方程式为?。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4。
该方案是否合理?(填“是”或“否”),理由是??。
(3)设计实验验证假设3:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,??,则假设3成立。(写明操作与对应的现象)
参考答案:(16分)Ⅰ.B:干燥SO2气体,防止较多的水蒸气与Na2O2反应………………(2分)
D:防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;同时吸收过量的SO2,以免污染空气。…………………………………………………………………(2分)
Ⅱ.用带用余烬的木条靠近干燥管口a,观察其是否燃烧。…………………(2分)
Ⅲ.有Na2SO3和Na2SO4? ……(2分)?(1)Na2O2 + SO2 = Na2SO4 ……(2分)
(2)否………(1分)? HNO3?有氧化性,可将据SO3?2-氧化成SO42-。……(2分)
(3)先加入过量的稀盐酸,产生剌激性气味气体,再加入适量的BaCl2溶液,又产生白色沉淀。(或先加入过量BaCl2溶液,产生白色沉淀;再加入过量的稀盐酸,白色沉淀部分溶解,并产生剌激性气味气体。)……(3分)
本题解析:
本题考点是:硫元素及其化合物,解题思路可以模仿Na2O2与CO2的反应,但要注意SO2除了是酸性氧化物外,还具有还原性。
制SO2原理:Na2SO3+H2SO4=Na2SO4+SO2↑,装置及作用:A制备SO2,→B干燥SO2→C、Na2O2与SO2反应→D尾气处理
Ⅰ.B:干燥SO2气体,防止较多的水蒸气与Na2O2反应;D:防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;同时吸收过量的SO2,以免污染空气。注意答案要全面;Ⅱ.检验O2,用带用余烬的木条靠近干燥管口a,观察其是否燃烧。Ⅲ.有Na2SO3和Na2SO4(1)Na2O2 + SO2 = Na2SO4(2)检验SO42―不合理, HNO3?有氧化性,可将据SO3?2-氧化成SO42-。
(3)合理的方案是:要排除SO32―的干扰。先加入过量的稀盐酸,产生剌激性气味气体,再加入适量的BaCl2溶液,又产生白色沉淀。(或先加入过量BaCl2溶液,产生白色沉淀;再加入过量的稀盐酸,白色沉淀部分溶解,并产生剌激性气味气体。)
本题难度:简单
3、选择题 在抢救大出血的病危病人时,常需静脉点滴0.9%氯化钠溶液(从俗称“生理盐水""),是由于人体血液的“矿化度”(即无机盐的含量)为0.9%。另有研究表明,30亿年前地表原始海水的“矿化度”即为
0.9%。对此,下列猜测或评论中不足取的是
[? ]
A.人体血液和原始海水的“矿化度”都为0.9%纯属巧合
B.人类祖先可能是从原始海洋逐渐进化到陆地上来的
C.人体血液和原始海水之间存在着某种尚未认识的关系
D.人体血液仍然带有原始海水的某些印痕
参考答案:A
本题解析:
本题难度:一般
4、填空题 为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。请填空:
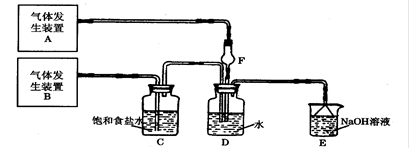
(1)D装置中主要反应的离子方程式为?,F仪器的作用是?。
(2)为验证通入D装置中的气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
a 氯化铁稀溶液? b 氯化亚铁溶液? c 硫氰化钾溶液?
d 苯酚溶液? e 品红溶液? f 酸性高锰酸钾溶液
①若Cl2过量:取适量D中溶液滴加至盛有?(选填一个符号)试剂的试管内,再加入?(选填一个符号)试剂,发生的现象是:?;
②若选用上述试剂中的一种再结合必要的操作就可以验证通入D装置中的气体是Cl2过量还是SO2过量,该试剂是?(选填一个符号)。必要的操作和结论是?。
参考答案:(共12分)(1)Cl2+SO2+2H2O=4H++2Cl―+SO42- (2分);?防倒吸(2分);
(2)① b (1分);? c(或d)(1分);?溶液呈红色(或紫色)(2分);
② e(2分);品红褪色,加热不复原,说明氯气过量;品红褪色,加热又复原,说明二氧化硫过量。(2分)
本题解析:(1)氯气具有氧化性,能把SO2氧化生成硫酸和盐酸,反应的离子方程式是Cl2+SO2+2H2O=4H++2Cl―+SO42-。由于SO2易溶于水,也易与水反应,且溶解度较大会发生倒吸,则F装置的作用是防止倒吸。
(2)①若Cl2过量,则所得溶液具有强氧化性,能把亚铁离子氧化生成铁离子,据此可以通过检验铁离子来检验氯气是否过量,即答案选b、c或d。
②因氯气和二氧化硫都具有漂白性,则选择品红来检验是Cl2过量还是SO2过量,即答案选e。若品红褪色,加热不复原,说明氯气过量;品红褪色,加热又复原,说明二氧化硫过量。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养。该题的关键是明确物质的性质及发生的化学反应,并能灵活运用即可。
本题难度:一般
5、实验题 某研究性学习小组进行溴乙烷的制备及性质探究实验。
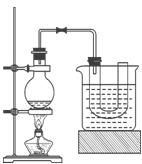
探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
A.氢氧化钠稀溶液
B.碳酸钠稀溶液
C.硝酸银溶液
D.四氯化碳