微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器。两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2 N2O4,分别经过一段时间后,A、B都达到平衡,下列有关叙述正确的是
N2O4,分别经过一段时间后,A、B都达到平衡,下列有关叙述正确的是
[? ]
A.平均反应速率A>B
B.平衡时NO2的物质的量B>A
C.平衡时NO2的转化率A>B
D.平衡时N2O4的物质的量B>A
参考答案:D
本题解析:
本题难度:一般
2、填空题 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
①Ni(s)+4CO(g) Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
②Ni(CO)4(g)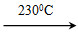 Ni(s)+4CO(g)
Ni(s)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有____________、____________ 。
(2)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时_______________?。
a.平衡常数K增大 ? b.CO的浓度减小
c.Ni的质量减小? d.v逆[Ni(CO)4]增大
(3)简述羰基法提纯粗镍的操作过程____________________________________________。
参考答案:(1)增大CO浓度 加压 (2)bc
(3)把粗镍和CO放于一个水平放置的密闭的玻璃容器中,然后在低温下反应,一段时间后在容器的一端加热
本题解析:(1)反应①是正向气体体积缩小的放热反应,因此,根据平衡移动原理在温度不变的情况下可采取增大CO浓度,加压的方法提高产率;
(2)反应(2)是正向气体体积增大的吸热反应,则降低温度平衡逆向移动,平衡常数K、CO的浓度、Ni的质量、v逆[Ni(CO)4]减小;(3)根据反应①②的特点可提纯粗镍。
本题难度:一般
3、填空题 关于可逆反应达到平衡状态的说法错误的是
A.达平衡时正、逆反应速率相等
B.是动态平衡
C.各组分的含量不随时间而变化
D.外界条件不能改变平衡
参考答案:D
本题解析:略
本题难度:一般
4、填空题 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ·mol—1,N≡N键能为946 kJ·mol—1,N—H键能为391 kJ·mol—1。写出合成氨反应的热化学方程式:?
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min
| 5
| 10
| 15
| 20
| 25
| 30
|
c(NH3)/mol·L—1
| 0.08
| 0.14
| 0.18
| 0.20
| 0.20
| 0.20
|
①5min内,消耗H2的平均反应速率为___________________________________?
②N2的平衡转化率?
③此条件下该反应的化学平衡常数K=__________________________。反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向_______方向移动(填“正反应”或“逆反应”)。
④若维持容器体积不变,只升高温度化学平衡常数值?(填变大、变小、不变),正反应速率?(填变大、变小、不变)。
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度?0.4 mol·L—1(填大于、小与、等于)
参考答案:(1)N2(g)? +? 3H2(g)  2NH3 (g)?△H=-92kJ· mol-1(3分)
2NH3 (g)?△H=-92kJ· mol-1(3分)
(2)①0.024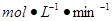 ? (2分)?②20%(2分)
? (2分)?②20%(2分)
③ O.1[或0.1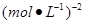 ] (2分)?正反应? (2分)
] (2分)?正反应? (2分)
④ 变小(2分),变大(2分)
⑤大于(2分)
本题解析:略
本题难度:一般
5、计算题 (I)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O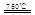 CaO+2HBr?②2HBr+Hg
CaO+2HBr?②2HBr+Hg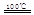 HgBr2+H2
HgBr2+H2
③HgBr2+_____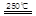 _____ + ??④2HgO
_____ + ??④2HgO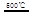 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________?_。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________?__。
(II)氢气常用生产水煤气的方法制得。CO(g)+H2O(g) CO2(g)+H2(g)?△H<0
CO2(g)+H2(g)?△H<0
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若x="5.0" mol,其它物质的投料不变,当上述反应达到平衡后,求H2的体积分数(计算结果保留两位有效数字)。
参考答案:(16分)?
(I)HgBr2+CaO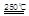 HgO+CaBr2(3分)?
HgO+CaBr2(3分)?
循环过程需要很高的能量,且使用重金属汞,会产生污染(3分)
(II)(1)小于(2分) (2) ①逆反应 (1分)?② 0≤x<3 (2分)
(3)解:设到达平衡时,H2或CO2减少amol,则CO、H2O增加amol,则:
CO(g)+H2O(g)  ?CO2(g)+H2(g)
?CO2(g)+H2(g)
初始物质的量/mol? 1.0? 3.0? 1.0? 5.0
变化物质的量/ mol? a? a?a? a
平衡物质的量/mol? 1.0+a? 3.0+a? 1.0-a? 5.0-a?(2分)
K=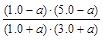 =1,解得a=0.20?(1分)
=1,解得a=0.20?(1分)
平衡时H2的体积分数=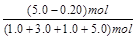 ×100% = 48%?(2分)
×100% = 48%?(2分)
本题解析:(I)依题意,①的生成物是②的反应物,②的生成物是③的反应物,③的生成物是④的反应物,④的反应物是HgO,则③的生成物是HgO,根据质量守恒定律可知,③的另一种反应物和生成物分别是CaO、CaBr2;(①+②+③)×2+④可得:2H2O=2H2↑+O2↑;上述4个反应都需要加热,因此消耗很多的能量才能循环制氢;上述过程中使用Hg、可溶性汞盐,它们属于重金属或重金属盐,则制氢过程能产生污染;II.(1)△H<0,说明正反应是放热反应;其它条件不变时,升高温度平衡向吸热反应方向移动,即850℃变为950℃时,平衡向逆反应方向移动,平衡常数减小,则K<1;(2)①依题意,起始时,生成物浓度幂之积与反应物浓度幂之积的比值为(1.0×5.0)/(1.0×3.0)=5/3,大于该温度下的平衡常数,说明起始时反应从逆反应方向开始进行,使生成物浓度减小、反应物浓度增大,当生成物浓度幂之积与反应物浓度幂之积的比值为1时,达到850℃时的化学平衡;②若起始时,生成物浓度幂之积与反应物浓度幂之积的比值小于1,即(1.0×x)/(1.0×3.0)<1,则0≤x<3.0;(3)设到达平衡时,H2或CO2减少amol,则CO、H2O增加amol,则:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
初始物质的量/mol? 1.0? 3.0? 1.0? 5.0
变化物质的量/mol? a? a? a? a
平衡物质的量/mol? 1.0+a? 3.0+a? 1.0-a? 5.0-a
K=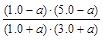 =1,解得a=0.20
=1,解得a=0.20
平衡时H2的体积分数=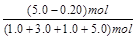 ×100% = 48%。
×100% = 48%。
本题难度:困难