微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (2014届江苏省扬州中学高三年级模拟考试化学试卷)
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
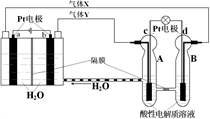
A.转移0.1mol电子时,a电极产生标准状况下O2 1.12L
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
参考答案:C
本题解析:
?
?A.由装置图可以看出左边的池为电解池,右边的池为原电池。b是阳极,a是阴极,发生还原反应:2H++2e-=H2↑。每转移2mol的电子,a电极产生标准状况下H2 11.2L。现在转移电子0.1mol,所以产生标准状况下H2 0.56L。错误。B.b电极为阳极。电极上发生的电极反应是:4OH--4e-=2H2O+ O2↑。错误。C.c电极上通入的是氧气,得到电子,发生还原反应,根据同种电荷相互排斥,异种电荷相互吸引。B电池中的H+可以通过隔膜进入负电荷较多的A池中的正极。正确。D.在右边的原电池中的负极d电极上发生的电极反应是:2H2-4e-=+4H+。错误。
本题难度:一般
2、填空题 (共13分)I(7分)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
II(6分)燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置。燃料和空气分别送进燃料电池,电就被奇妙地生产出来。它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”。
(4)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入电解质溶液中,其电池反应为4NH3+3O2=2N2+6H2O
写出该燃料电池的正极反应式
(5)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。
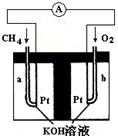
①放电时,负极的电极反应式为:
②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为:
参考答案:(1)负;4Al2Cl7— + 3e— =" Al" + 7AlCl4—;H2 (2) 3
(3)b、d;不能;Fe2O3+6H+ = 2Fe3+ + 3H2O Fe + 2Fe3+ = 3Fe2+
(4)O2 + 2H2O+ 4e— = 4OH—
(5)①CH4-8e—+10OH—= CO32—+7H2O ②c(K+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+)
本题解析:(1)根据电解原理知,在钢制品上电镀铝,钢制品为镀件,作阴极,连接电源的负极;电镀铝阴极应生成单质铝,所以阴极电极反应式为:4 Al2Cl7—+3e?=Al+7 AlCl4—;若改用AlCl3水溶液作电解液,H2O电离产生的H+放电生成H2;(2)用NaOH溶液溶解钢制品表面的铝镀层的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑还原产物为H2,与转移电子的对应关系为:H2 ~ 2e?,n(H2)=1/2n(e?)=1/2×6mol=3mol;(3)铝热反应需要用Mg和KClO3提供高温条件,选b、d;H2SO4与Fe2O3反应可生成Fe3+,但铝热反应生成的Fe可将Fe3+还原为Fe2+,发生反应:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,加入KSCN,无明显现象;(4)NH3燃料电池,其电池反应为 4NH3+3O2=2N2+6H2O,该燃料电池的正极反应式O2 + 2H2O+ 4e— = 4OH—;(5)①碱性甲烷燃料电池放电时,甲烷在负极失电子,生成碳酸根,利用电荷守恒和原子守恒配平,电极反应式为:CH4-8e—+10OH—= CO32—+7H2O;②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL,物质的量为0.4mol,转移的电子为0.16mol,利用电子守恒知参加反应的甲烷为0.02mol,生成的二氧化碳为0.02mol,与100.0 mL 3.0 mol·L—1 KOH溶液反应后电解质溶液为等浓度的碳酸钾和碳酸氢钾的混合液,各离子浓度的大小关系为:c(K+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+)。
考点:考查电化学原理、氧化还原反应原理、铝热反应、离子浓度大小比较。
本题难度:困难
3、选择题 在盛有稀H2SO4的烧杯中插入用导线连接的锌片和铜片,下列叙述正确的是
[? ]
A.正极附近的SO4 2-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.溶液的pH逐渐变小
D.铜片上H2有逸出
参考答案:D
本题解析:
本题难度:一般
4、填空题 金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金。
(1)快中子反应堆的热交换剂用的是钠钾合金,其常温下是 态(填气、液、固)。把钠的物质的量分数为20%的0.2mol的此合金安全地加入到重水(D2O)中,产生的气体物质所含的中子数为 。
(2)镁铝合金是经常见到的轻质合金。剪一块合金在空气中燃烧,除生成MgO和Al2O3外,最有可能生成的第三种物质的电子式是 。当一块5.1g的镁铝合金薄片溶于3.6 mol·L-1的200ml 的硫酸溶液中,至少需加入1 mol·L-1的氢氧化钠溶液的体积 mL至沉淀质量不再改变,如整个过程中有0.5mol 的电子发生转移,则合金中Mg的物质的量分数为 。
(3)①有一种铜的合金即黄铜(可看作是Cu和Zn),可分别用酸溶法或碱溶法来分离该两种金属,其中把该合金投入到稀盐酸中,发现产生气泡的速度比用锌与盐酸反应制氢气的速度快,其原因是 。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图信息推断该合金中除铜外一定含有 。
参考答案:(1)液 0.2NA (2)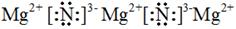 1440;50%
1440;50%
(3)①铜锌合金可以形成原电池,加快化学反应速率。 ②Al、Ni
本题解析:(1)钠钾合金,其常温下是液态;钠的物质的量分数为20%的0.2mol的此合金中钠和钾的物质的量分别是0.04mol和0.16mol。根据方程式2Na+2H2O=2NaOH+H2↑↑可知,与水反应生成氢气的物质的量分别是0.02mol和0.08mol,共计是0.10mol。由于氢气的组成D2,分子中含有中子数是2个,所以产生的气体物质所含的中子数为0.2NA。
(2)由于镁能与氮气反应生成氮化镁,而空气中含有大量的氮气,所以第三种物质应该是氮化镁,氮化镁是离子化合物,电子式为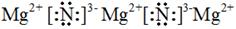 。当沉淀不再发生变化时,此时恰好反应生成氢氧化镁和氢氧化铝沉淀,而溶液中只含有硫酸钠,物质的量是3.6mol/L×0.2L=0.72mol,则关节炎钠离子守恒可知,至少需要氢氧化钠的物质的量是0.72mol×2=1.44mol,其溶液体积为1.44mol÷1.0mol/L=1.44L=1440ml;设合金中Mg、Al的物质的量分别为x和y,则2x+3y=0.5mol、24g/mol×x+27g/mol×y=5.1g,解得x=y=0.1mol,因此合金中Mg的物质的量分数为50%。
。当沉淀不再发生变化时,此时恰好反应生成氢氧化镁和氢氧化铝沉淀,而溶液中只含有硫酸钠,物质的量是3.6mol/L×0.2L=0.72mol,则关节炎钠离子守恒可知,至少需要氢氧化钠的物质的量是0.72mol×2=1.44mol,其溶液体积为1.44mol÷1.0mol/L=1.44L=1440ml;设合金中Mg、Al的物质的量分别为x和y,则2x+3y=0.5mol、24g/mol×x+27g/mol×y=5.1g,解得x=y=0.1mol,因此合金中Mg的物质的量分数为50%。
(3)①由于锌的金属性强于铜,通入到盐酸中,铜锌合金可以形成原电池,加快化学反应速率。
②由图可知,结合题中信息可知开始出现沉淀为Al(OH)3、pH=8.0时过滤除去Ni(OH)2,因此该铜合金中还含Al、Ni。
考点:考查金属、合金的组成与性质、根据方程式进行的有关计算以及溶解平衡的应用
本题难度:一般
5、选择题 如图各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为( )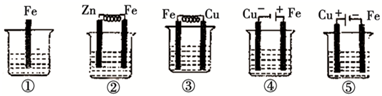
A.②①③④⑤
B.④③①②⑤
C.⑤④②①③
D.⑤③②④①
参考答案:作原电池负极或作电解池阳极的金属加速被腐蚀,作原电池正极或电解池阴极的金属被保护,金属被腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,
①中铁发生化学腐蚀;
②中铁作正极,被保护;
③中Fe易失电子作负极,加速被腐蚀;
④中铁作阳极,加速被腐蚀;
⑤中铁作阴极,被保护;
通过以上分析知,Fe被腐蚀由快到慢顺序是④③①②⑤,故选B.
本题解析:
本题难度:一般