微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 海带中含有碘元素,碘元素以碘离子(I-)的形式存在.经常食用海带可以防治甲状腺肿大,所以工业上常用海带为原料提取碘单质.查有关资料可知碘单质有升华现象.下面是某校化学探究小组设计的从海带中提取碘单质的实验,请完成下列实验.
(1)将干燥洁净的海带用酒精湿润后在______(填一种仪器名称)中灼烧成灰烬.
(2)将海带灰烬冷却至室温,将其转移到烧杯中,加蒸馏水后,搅拌、煮沸、冷却、______(填一种操作名称).
(3)在滤液中滴入几滴稀硫酸,再加入一定量的过氧化氢(H2O2)溶液,此时发生反应的离子方程式为______.
(4)把(3)中所得的溶液注入______(填一种仪器名称)中,然后再加入四氯化碳,振荡、静置,可以观察到四氯化碳层呈______色.经分液得到碘的四氯化碳溶液,在这一实验过程中,四氯化碳起______的作用.
(5)将碘的四氯化碳溶液中的碘单质和四氯化碳分离出来的方法是______.
(6)证明得到的固体是碘单质的化学方法是______.
2、填空题 海水占地球储水总量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表______族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是_________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水的方法,可制得重要的化工产品,反应式为食盐+H2O(电解) NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是_________________;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐_____ t。(可能用到的相对原子质量为Na:23、C1:35.5、H:l、O:16)
NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是_________________;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐_____ t。(可能用到的相对原子质量为Na:23、C1:35.5、H:l、O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
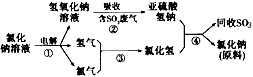
请写出②、④的化学反应方程式_____________________________ ;
________________________________。
3、选择题 海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示), 下列有关说法正确的是
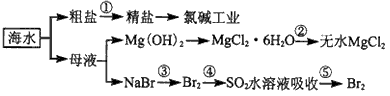
[? ]
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe 3+等杂质,加入的药品顺序为:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
B.第②步中结晶出的MgCl2·6H2O可在空气中受热分解制,无水MgCl2
C.在第③④⑤步中溴元素均被氧化
D.从第③步到第⑤步的目的是浓缩
4、选择题 海水是一个巨大的化学资源库,下列有关海水综合利用的说法中,正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到单质钾
B.海水蒸发制盐的过程中只发生了化学变化
C.从海水中除得到氯化钠外,还可用其作原料制得纯碱、烧碱、金属钠及氯气、盐酸等含氯化产品
D.利用潮汐发电是将化学能转化为电能
5、填空题 海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下图:
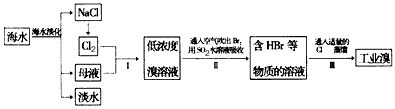
(1)步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为____________________;
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,反应方程式为__________________;
(3)Br-的检验主要试剂是__________,离子方程式为_______________________;
(4)从工业溴中提纯溴,查阅了有关资料,Br2的颜色为__________ ,沸点为59℃,微溶于水,有毒性和强腐蚀性;
(5)上述工业残留液中有少量Cl2,可向其中加入NaBr溶液,反应的离子方程式为_________________,反应后其分离操作是________。