微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 超重元素“稳定岛”的假设预言:自然界中可能存在着原子序数为114的元素的稳定同位素208X.1999年人们发现了114号元素,有力地支持了“稳定岛”学说.请你根据已知的元素周期律预测208X在元素周期表中的位置
A.第八周期Ⅷ族
B.第七周期ⅥA族
C.第七周期ⅣA族
D.第六周期ⅠB族
参考答案:C
本题解析:根据已有的元素周期律,第七周期如果排满,应排到118号,即118号元素应位于第七周期0族(第18列),由此可知114号元素应位于同一周期,第ⅣA族(第14列).
本题难度:一般
2、填空题 W、X、Y、Z为短周期内除稀有气体元素外的四种元素。它们的原子序数依次增大。其中只有Y是金属元素,Y的最外层电子数和W最外层电子数相等,Y、Z两元素的质子数之和为W、X两元素质子数之和的3倍。由此可知元素W为 ____;X为____;Y为___;Z为___。上述元素中任意三种组成的,既含有离子键又含有共价键的化合物的化学式(至少写三种)_____、____、____,四种元素两两相结合,能生成共价化合物的化学式有(至少写四种)____、____、____、____。
参考答案:H ;O ;Na ;S
NaOH ;NaHS ;Na2SO4 ;Na2SO3中的3种
H2O ;H2S ;SO2 ;H2O2 ;SO3中的4种
本题解析:
本题难度:一般
3、简答题 下表是元素周期表的一部分,表中所列字母分别代表短周期中的一种元素.
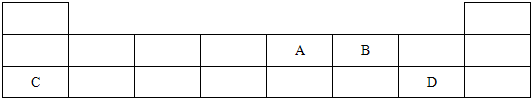
(1)A单质的电子式是______;B元素在周期表中的位置是______.
(2)D单质与C的最高价氧化物对应水化物反应的离子方程式是______.
(3)B、C两元素分别形成的离子的半径关系:B______C(填“>”“=”或“<”).
(4)A的气态氢化物与D的气态氢化物反应的产物是______,该产物中含有的化学键类型是______.
(5)下列事实不能说明D的非金属性比A的非金属性强的是______.
a.D的氢化物比A的氢化物稳定
b.D的最高正化合价大于A的最高正化合价
c.D的最高价含氧酸比A的最高价含氧酸的酸性强.
参考答案:由元素在周期表中的位置可知,A为N,B为O,C为Na,D为Cl,
(1)N的最外层有5个电子,单质中存在三对共用电子对,其电子式为

;B的质子数为8,在元素周期表中的第二周期第ⅥA族,
故答案为:

;第二周期第ⅥA族;
(2)氯气与NaOH溶液反应生成氯化钠、次氯酸钠、水,离子反应为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(3)钠离子、氧离子具有相同电子排布的离子,Na的原子序数大,其离子半径小,故答案为:<;
(4)氨气与HCl反应生成氯化铵,其化学式为NH4Cl,含有离子键、共价键,故答案为:NH4Cl;离子键、共价键;
(5)a.D的氢化物比A的氢化物稳定,则D的非金属性强,故a选;
b.D的最高正化合价大于A的最高正化合价,不能比较非 金属性的强弱,故b不选;
c.D的最高价含氧酸比A的最高价含氧酸的酸性强,则D的非金属性强,故c选;
故答案为:ac.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.原子序数越大,原子半径一定越大
B.原子的电子层数越多,半径越大
C.元素性质的周期性变化不是元素性质的简单重复
D.按C、N、O、F的顺序,元素的最高正价依次升高
参考答案:C
本题解析:原子半径随原子序数的递增不是一直在增大,而是呈周期性变化,故A选项不正确;原子半径的大小受电子层数、核电荷数及核外电子数等因素的影响,其中电子层数是主要的,但不是唯一因素,例如,Cl原子比Li多一个电子层,但原子半径r(Li)>r(Cl),故B项不正确;元素性质的周期性变化不是简单的重复变化,变化的程度不同,变化的起点和终点也不同,故C项是正确的;氟是最活泼的非金属元素,它只有负价,没有正价;氧的非金属性也很强,一般只有负价,故D选项不正确.
本题难度:困难
5、选择题 有下列电子排布式的原子中,第一电离能最小的是
A.ns2np3
B.ns2np4
C.ns2np5
D.ns2np6
参考答案:B
本题解析:每个周期的第一种元素第一电离能最小,最后一种元素(稀有气体)的第一电离能最大。但是有反常电离能半充满和全空比较稳定,比如第二周期的O<N。第三周期的Mg>Al,P>S.
本题难度:简单