微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 元素性质呈周期性变化的原因
A.原子量逐渐增大
B.元素的化合价呈周期性变化
C.核外电子排布呈周期性变化
D.原子序数逐渐增大
参考答案:C
本题解析:
本题难度:一般
2、推断题 X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是__________________(用元素符号表示).
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________.
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族2~5周期元素单质分别与H2反应生成1?mol气态氢化物的反应热如下,表示生成1?mol硒化氢反应热的是________(填字母代号).
a.+99.7?kJ/mol b.+29.7?kJ/mol ?c.-20.6?kJ/mol? d.-241.8?kJ/mol
参考答案:(1)O;第3周期第ⅢA族;Al>C>N>O>H
(2)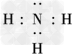 ;
;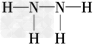
(3)34;H2SeO4;b
本题解析:
本题难度:一般
3、选择题 1898年,居里夫妇经过一段漫长、枯燥而又艰苦的工作,终于从数吨的沥青铀矿石中提炼出一小撮放射性粉末,并分离出了两种放射性元素钋和镭,其中镭是元素周期表中第7周期ⅡA族的元素,下列关于镭的性质的描述中,不正确的是
A.镭原子最外电子层上有2个电子
B.单质能和水剧烈反应放氢气
C.氢氧化镭的碱性比Ca(OH)2弱
D.碳酸镭难溶于水
参考答案:C
本题解析:试题分析:A.镭最外层有2个电子,在化合物中呈+2价,故A正确;
B.同主族元素从上到下金属性逐渐增强,镭的金属性较强,单质性质活泼,与水反应放出氢气,故B正确;
C.同主族元素从上到下金属性逐渐增强,镭的金属性较强,镭比钙的金属性强,氢氧化镭的碱性比Ca(OH)2强,故C错误;
D.同主族元素性质相似,碳酸钙不溶于水,则碳酸镭难溶于水,故D正确。
故选C。
考点:元素周期律和元素周期表的综合应用
点评:本题考查同主族元素的性质的递变规律,从同主族元素金属性对应单质、化合物的性质的相似性和递变性的角度解答该题,题目难度不大。
本题难度:困难
4、选择题 甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.X+2
B.X+4
C.X+8
D.X+18
参考答案:由元素周期表结构可知,对于处于同一主族不同周期的元素,原子序数相差可能为2、8、18、32等,不可能相差4.
故选B.
本题解析:
本题难度:一般
5、推断题 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是________。
(2)X与W组成的化合物中存在________键(填“离子”或“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为_________________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A。
①已知1?mol?A能与足量NaOH浓溶液反应生成标准状况下44.8?L气体。写出加热条件下A与NaOH溶液反应的离子方程式___________________________。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式___________________________________。
参考答案:(1)H
(2)共价
(3)3Cu+2NO3-+8H+===3Cu2++2NO↑+4H2O
(4)①NH4++OH- H2O+NH3↑;②SO32-+Cl2+H2O=SO42-+2Cl-+2H+
H2O+NH3↑;②SO32-+Cl2+H2O=SO42-+2Cl-+2H+
本题解析:
本题难度:一般