微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 利用铜棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当铜棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。请回答下列问题
(1)该原电池的正极反应式为:______________________
(2)计算原稀硫酸的物质的量浓度。
参考答案:(1)2H++2e-==H2↑
(2)0.75mol/L
本题解析:
本题难度:一般
2、选择题 某原电池的总反应为:Cu + 2Fe3+ = Cu2+ + 2Fe2+
| A
| B
| C
| D
|
电极材料
| Cu、Zn
| Cu、Ag
| Fe、Zn
| Cu、C
|
插入溶液
| FeCl3
| Fe(NO3) 2
| CuSO4
| Fe2(SO4)3
|
参考答案:D
本题解析:由原电池的总反应可知,Cu发生氧化反应作负极,电解质中的Fe3+在正极发生还原反应,符合条件的为D。
考点:原电池反应。
本题难度:一般
3、选择题 “暖宝宝”的主要原料有:铁粉、活性炭、水、食盐等。其中活性炭是原电池的电极之一,食盐的作用是溶于水形成电解质溶液。下列有关“暖宝宝”的说法中错误的是
[? ]
A.活性炭作用是作原电池的正极,加速铁粉的氧化
B.“暖宝宝”放出的热量是铁氧化时产生的
C.“暖宝宝”使用前要密封保存,使之与空气隔绝
D.活性炭最终将转化为二氧化碳
参考答案:D
本题解析:
本题难度:简单
4、简答题 甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②对于反应Ⅰ,下图甲表示能量的变化;图乙表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时闻峦化。
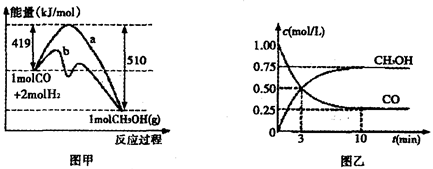
在“图甲”中,曲线__________(填:“a”或“b”)表示使用了催化剂;该反应属于________(填:“吸热”、“放热”)反应。在图乙中从反应开始到建立平衡,用H2浓度变化表示的反应速率为_____________;该温度下CO(g)+2H2(g) CH3OH(g)的化学平衡常数为__________.
CH3OH(g)的化学平衡常数为__________.
③对于反应Ⅱ,在一定温度时,将lmol CO2年和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则容器内的平衡压强与起始压强之比为__________;若容器容积不变,下列措施可增加甲醇产率的是____________。
a.升高温度
b.增加CO2的量
c.充入He,使体系总压强增大
d.按原比例再充入CO2和H2?
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种?污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程。
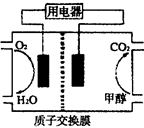
①阳极电极反应式为____________。
②除去甲醇的离子方程式为________________。
参考答案:(14分)(1)①反应I符合“原子经济性”的原则即原子利用率为100%(1分)
②b(1分)?放热(1分)? 0.15mol/(L·min)(2分)? 12(1分)③1-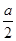 (2分)? bd(2分)
(2分)? bd(2分)
(2)①CO2+-e-=CO3+(2分)
②6 CO3++CH3OH+H2O=CO2↑+6 CO2++6H+(2分)
本题解析:(1)①根据反应I和反应Ⅱ的生成物可知,反应I中生成物只有一种,而反应Ⅱ中还有水生成,即反应I符合“原子经济性”的原则即原子利用率为100%,所以反应Ⅰ优于反应Ⅱ。
②根据图像甲可知,曲线b的活化能低于曲线a的活化能,所以曲线b表示使用了催化剂;同样根据图像甲可知,反应物的总能量高于生成物的总能量,所以反应是放热反应;根据图像乙可知,反应进行到10min是反应达到平衡状态,此时生成的甲醇浓度是0.75mol/L,则根据反应I可知,消耗氢气的浓度是1.5mol/L,所以氢气表示的反应速率是1.5mol/L÷10min=0.15mol/(L·min);平衡时氢气的浓度是2mol/L-1.5mol/L=0.5mol/L,所以根据CO和甲醇的平衡浓度可知,该温度下反应的平衡常数K= =12。
=12。
③?CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量(mol/L)? 1? 3? 0? 0
转化量(mol/L)? a? 3a?a? a
平衡量(mol/L)? 1-a? 3-3a? a? a
则根据压强之比是相应的物质的量之比可知
容器内的平衡压强与起始压强之比为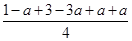 =1-
=1-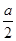
a.因正反应放热,升高温度可使平衡向逆反应方向移动,不能增加甲醇产率,故a不正确;
b.增加CO2的量,平衡向正反应方向移动,所以可以增加甲醇产率,故b正确;
c.充入He,使体系总压强增大,对于参加反应的物质来说,浓度不变,平衡不移动,甲醇产率不变,故c错误;
d.按原比例再充入CO2和H2压强增大,平衡向正反应方向移动,可以增加甲醇产率,故d正确。
答案选bd。
(2)①原电池中阳极失去电子,所以根据装置图可知,CO2+在阳极失去电子,阳极电极反应式为CO2+-e-=CO3+。
②Co3+做氧化剂,能把水中的甲醇氧化成CO2而净化,反应的离子方程式是6 CO3++CH3OH+H2O=CO2↑+6 CO2++6H+。
本题难度:一般
5、选择题 锌—空气电池可能成为未来的理想动力源,该电池的电解质溶液可以是酸性或碱性。在碱性溶液中该电池总反应可表示为:2Zn+4NaOH+O2=2Na2ZnO2 +2H2O。下列有关锌-空气电池说法正确的是
A.碱性电解质溶液中正极反应式为:4OH-- 4e-= O2↑+2H2O
B.碱性或酸性电解质溶液中,该电池正极反应式相同
C.该电池工作时,Na+移向负极
D.每生成1 mol ZnO22-转移电子数为2NA
参考答案:D
本题解析:A、碱性电解质溶液中正极应为O2得电子,错误;B、酸性溶液中正极反应式为:O2+4H++4e?=2H2O,碱性溶液中正极反应式为:O2+H2O+4e?=4OH?,正极反应式不同,错误;C、该电池工作时,Na+移向正极,错误;D、Zn元素化合价由0价升高至+2价,所以每生成1 mol ZnO22-转移电子数为2NA,正确。
本题难度:一般