微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下列反应中,属于放热反应的是____________,属于吸热反应的是_____________。
A.锌粒与稀H2SO4反应制取H2
B.Ba(OH)2·8H2O与NH4Cl反应
C.氢气在氧气中燃烧生成水
D.高温煅烧石灰石使其分解
E.氢气还原氧化铜
F.葡萄糖在人体内氧化分解
参考答案:ACF;BDE
本题解析:
本题难度:一般
2、填空题 在一个小烧杯里,加入20g?Ba(OH)2?8H2O粉末,将小烧杯放在事先已滴有3至4滴水的玻璃片上,然后加入10g?NH4Cl晶体,并用玻璃棒迅速搅拌.
(1)实验中玻璃棒的作用是______
(2)实验中观察到玻璃片结冰而与小烧杯粘结在一起,并伴有少许刺激性气味,同时看到反应混合物成糊.写出有关反应的化学方程式:______.
(3)通过______现象,说明该反应为______热反应,这是由于反应物的总能量______(填“大于”、“小于”或“等于”)生成物的总能量.
参考答案:(1)玻璃棒在化学实验中的作用:搅拌和引流,本实验中,根据题意:将20g?Ba(OH)2?8H2O晶体与10g?NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌,可以知道玻璃棒的作用是:搅拌使混合物充分接触并反应,故答案为:搅拌使混合物充分接触并反应;
(2)氯化铵属于铵盐,能和强碱氢氧化钡反应生成氨气、水、以及氯化钡,化学方程式为Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,
故答案为:Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
(3)玻璃片上结冰而与小烧杯粘在一起,说明氢氧化钡和氯化铵的反应是吸热反应,即反应物的总能量小于生成物的总能量,故答案为:结冰;吸;小于.
本题解析:
本题难度:一般
3、简答题 能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
写出表示甲醇燃烧热的热化学方程式:______.
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1
反应B:CO(g)+2H2(g)?CH3OH(g)△H2
取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)?与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的△H1______0(填“>”、“<”或“=”).
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是______.
A.升高温度?B.增加CO2的量
C.充入He,使体系总压强增大?D.按原比例再充入CO2和H2
③某温度下,将4mol?CO和12mol?H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.5mol?L-1,则该温度下该反应的平衡常数为______.
④.某种甲醇-空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液.其工作时负极的电极反应式可表示为______
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1:1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥,则该反应的化学方程式为______.
(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)______?c(NO3-)+c(OH-)(填写“>”“=”或“<”)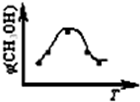
参考答案:(1)2CH3OH(I)十3O2(g)═2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1 ①
? H2O(l)=H2O(g)△H=+44kJ/mol? ②
①-②×4得:2CH3OH(I)十3O2(g)═2CO2(g)+4H2O(g)△H=_1451.6kJ?mol-1
在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热.
所以表示甲醇燃烧热的热化学方程式:CH3OH(g)+32O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
故答案为:CH3OH(g)+32O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(2)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H1<0,故答案为:<;
②A.由①可知,该反应放热,升温,平衡向逆反应方向移动,甲醇产率减小,故A错误;
B.增加CO2的量,平衡向正反应方向移动,甲醇产率增大,故B正确;
C.充入He,使体系总压强增大,各物质的浓度不变,平衡不移动,故C错误
D.按原比例再充入CO2和H2,由等效平衡可知平衡正向移动,甲醇产率增大,故D正确;
故选:BD.
③CO(g)+2H2(g)?CH3OH(g)
起始(mol?L-1)? 2? 6? 0?
反应(mol?L-1)? 1.5? ?3? 1.5?
平衡(mol?L-1)?0.5? 3? 1.5?
平衡常数K=C(CH3OH)C(CO)C2(H2)=1.5?0.5?×3?2?=0.33,故答案为:0.33;
④总反应式为2CH3OH+3O2=2CO2+4H2O,正极反应式:3O2+12H++12e-═6H2O;总反应式减去正极反应式即为负极反应式,
所以负极反应式为:2CH3OH+2H2O-12e-═12H++2CO2;故答案为:2CH3OH+2H2O-12e-═12H++2CO2
(3)反应方程式为12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3,
故答案为:12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3;
(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,溶液中含有的离子为:Na+、H+、NH4+、NO3-、OH-,电荷守恒为:c(Na+)+c(H+)+C(NH4+)=c(NO3-)+c(OH-),
所以:c(Na+)+c(H+)<c(NO3-)+c(OH-),故答案为:<.
本题解析:
本题难度:一般
4、选择题 对于反应中的能量变化,表述正确的是
[? ]
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.氧化反应均为吸热反应
参考答案:A
本题解析:
本题难度:一般
5、选择题 S8分子形成的单斜硫和斜方硫是同素异形体,转化关系 如下
S(斜方,固)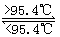 S(单斜,同) △H=0. 398 kJ·mol-1
S(单斜,同) △H=0. 398 kJ·mol-1
若NA为阿伏加德罗常数,则下列说法中,不正确的是?
[? ]
A.单斜硫比斜方硫具有的能量略高
B.单斜硫和斜方硫之间的转化属于物理变化
C.单斜硫和斜方硫在充足的氧气中燃烧均生成SO2
D.64 g单斜硫和斜方硫的混合物含硫原子数目为2NA
参考答案:B
本题解析:
本题难度:简单