微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2012年6月16日18时37分24秒,神舟九号成功发射。飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气,电解质为熔融的碳酸钾。已知该燃料电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32—-2e-=CO2↑+H2O,则下列推断正确的是( )。
A.电池工作时,CO32—向负极移动
B.电池放电时,电子经外电路由通氧气的正极流向通氢气的负极
C.正极的电极反应为4OH--2e-=O2↑+2H2O
D.通氧气的电极为正极,发生氧化反应
参考答案:A
本题解析:原电池放电时,电子由负极经外电路流向正极,B错误;正极反应为O2+4e-+2H2O=4OH-,C错误;通氧气一极为正极,发生还原反应,D错误。
本题难度:一般
2、选择题 有一种MCFC型燃料电池,该电池所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应为:2H2+O2===2H2O,负极反应:H2+CO32--2e-===H2O+CO2。下列说法正确的是
A.电路中的电子经正极、熔融的K2CO3、负极后再到正极,形成闭合回路
B.电池放电时,电池中CO32-的物质的量将逐渐减少
C.正极反应为2H2O+O2+4e-===4OH-
D.放电时CO32-向负极移动
参考答案:D
本题解析:A、原电池中电子只能通过导线传递,溶液中是靠离子的移动而导电,因此该原电池中电子从负极传递到正极,不经过熔融的碳酸钾,A不正确;B、根据电池的电池的总反应式2H2+O2===2H2O可知,电池放电时,电池中CO32-的物质的量不变,B不正确;C、总反应减去负极反应即得到正极反应式,所以正极反应式为2CO2+O2+4e-===2CO32-,C不正确;D、原电池中电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,阴离子则向负极移动,D正确,答案选D。
本题难度:一般
3、选择题 下列各组的电极材料和电解液,不能组成原电池的是( )
A.铜片、石墨棒,稀硫酸
B.铜片、石墨棒,硝酸银溶液
C.锌片、铜片,稀盐酸
D.铜片、银片,FeCl3溶液
参考答案:A、铜片和稀硫酸不能自发的发生氧化还原反应,所以不能构成原电池,故A符合;
B、两电极的活泼性不同,且铜片与硝酸银溶液能自发的发生氧化还原反应,所以能构成原电池,故B不符合;
C、两金属的活泼性不同,且锌片与稀盐酸能自发的发生氧化还原反应,所以能构成原电池,故C不符合;
D、两金属的活泼性不同,且铜片与氯化铁溶液能自发的发生氧化还原反应,所以能构成原电池,故D不符合;
故选A.
本题解析:
本题难度:一般
4、填空题 1991年我国首创以铝-空气-海水为能源的新型“海水电池”,该电池以海水为电解质溶液,靠空气中的氧使铝不断氧化而产生电流。它比干电池能量高20~50倍。其总反应式表示为:4Al+3O2+6H2O===4Al(OH)3。
(1)该电源的负极材料为?,(2)写出正极反应式为 :?。
参考答案:(1)铝 ?(2) O2+2H2O+4e-===4OH-
本题解析:(1)原电池中,负极发生氧化反应;根据题意知,该电池以海水为电解质溶液,靠空气中的氧使铝不断氧化而产生电流,则负极材料为铝;(2)原电池工作时,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-。
本题难度:简单
5、填空题 (18分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
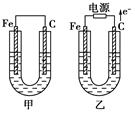
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _
(2)若两池中均为饱和NaCl溶液:
①乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”),写出乙池中该电极反应的离子方程式_______________________________________。
②甲池中碳极上电极反应式是_____________,检验该负极反应产物的方法是_____________________________用离子方程式表示_______________________________
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的pH=________。
参考答案:
(1)①碳 铁
②4OH--4e-===2H2O+O2↑
(2)① 氧化反应 2Cl--2e-=Cl2↑-
②2H2O+O2+4e- =4OH- 滴加2滴铁氰化钾溶液,看到有蓝色沉淀出现,说明生成了Fe2+ 3Fe2+ +2[Fe(CN)6]3-
=4OH- 滴加2滴铁氰化钾溶液,看到有蓝色沉淀出现,说明生成了Fe2+ 3Fe2+ +2[Fe(CN)6]3-  = Fe3[Fe(CN)6]2(蓝色),生成物叫普鲁士蓝
= Fe3[Fe(CN)6]2(蓝色),生成物叫普鲁士蓝
③13
本题解析:
(1)①碳(正极) 铁(阴极)
②阳极为碳棒,失电子,4OH--4e-===2H2O+O2↑
(2)① 氧化反应 2Cl--2e-=Cl2↑-
②2H2O+O2+4e- =4OH- 滴加2滴铁氰化钾溶液,看到有蓝色沉淀出现,说明生成了Fe2+ 3Fe2+ +2[Fe(CN)6]3-
=4OH- 滴加2滴铁氰化钾溶液,看到有蓝色沉淀出现,说明生成了Fe2+ 3Fe2+ +2[Fe(CN)6]3-  = Fe3[Fe(CN)6]2(蓝色),生成物叫普鲁士蓝
= Fe3[Fe(CN)6]2(蓝色),生成物叫普鲁士蓝
③H+ 浓度为:0.02mol/0.200L=0.1mol/L,pH= 13
本题难度:简单